摘要:p-tau262和p-tau356,检测纤维前tau聚集体的形成。
阿尔茨海默病研究新突破:
来自瑞典哥德堡大学萨尔格伦斯卡学院精神病学和神经化学系等多个单位的研究人员在国际知名期刊《Nature Medicine》上发表了题为“Phospho-tau serine-262 and serine-356 as biomarkers of pre-tangle soluble tau assemblies in Alzheimer’s disease”的论文。该研究在阿尔茨海默病(Alzheimer's Disease, AD)领域具有里程碑意义,为深入理解 AD 早期病理机制、开发新型诊断方法和治疗策略提供了关键线索。
 图1 磷酸化tau丝氨酸-262和丝氨酸-356作为阿尔茨海默病前缠结可溶性tau组装的生物标志物
图1 磷酸化tau丝氨酸-262和丝氨酸-356作为阿尔茨海默病前缠结可溶性tau组装的生物标志物本研究聚焦于阿尔茨海默病早期病理过程中的关键蛋白——tau 蛋白。研究人员通过多种生化方法和临床样本验证,揭示了可溶性 tau 聚集体(Soluble Tau Assemblies, STAs)的核心结构特征及其在脑脊液(Cerebrospinal Fluid, CSF)中的检测方法。研究发现,特定的磷酸化 tau 蛋白(如 p-tau Serine-262 和 p-tau Serine-356)是早期 tau 聚集的关键生物标志物,其在 CSF 中的水平与 AD 病理进展和认知功能障碍密切相关。这一发现不仅为 AD 的早期诊断提供了新的生物标志物,还为开发针对早期 tau 聚集的治疗方法奠定了理论基础。
阿尔茨海默病(AD)是一种以神经原纤维缠结(Neurofibrillary Tangles, NFTs)和淀粉样 β(Amyloid-β, Aβ)斑块为主要病理特征的神经退行性疾病。NFTs 由 tau 蛋白异常聚集形成,其病理严重程度与认知功能障碍的相关性比 Aβ 斑块更强。然而,现有的诊断方法对 NFTs 形成前的早期 tau 变化缺乏敏感性,且针对成熟 tau 纤维的治疗面临诸多挑战。因此,寻找能够检测早期 tau 聚集的生物标志物成为 AD 研究的重要方向。
研究材料
研究使用了人类尸检大脑组织、脑脊液(CSF)样本、重组 tau 蛋白和小鼠等材料。人类大脑组织和 CSF 标本来自多个脑库和研究队列,包括伦敦大学学院皇后广场神经疾病脑库、荷兰脑库和加州大学圣地亚哥分校的 Shiley-Marcos 阿尔茨海默病研究中心(ADRC)等。
研究方法
FRET 测定:利用荧光共振能量转移(FRET)测定法定量人类尸检额叶灰质脑组织中的 STAs。通过将靶向 tau 蛋白特定序列的抗体分别与供体和受体分子偶联,当抗体与多价的 STAs 结合时会产生 FRET 信号,信号强度与 STAs 的数量和大小成正比。
免疫沉淀和质谱分析:使用多种抗 tau 抗体对大脑组织提取物进行免疫沉淀,结合质谱分析(MS)鉴定含有 STA 核心区域的 tau 形式。
免疫组化和免疫荧光:对尸检确诊的 AD 病例海马组织进行免疫组化和免疫荧分析光,检测不同磷酸化 tau 位点的表达和定位。
电生理学实验:制备小鼠海马脑片,孵育不同的重组 tau 肽段,利用全细胞膜片钳记录技术检测神经元的兴奋性和突触传递变化。
CSF 检测方法开发:基于研究发现,利用单分子阵列(Simoa)技术开发检测人类 CSF 中 STAs 的方法,并在多个队列中进行临床验证。
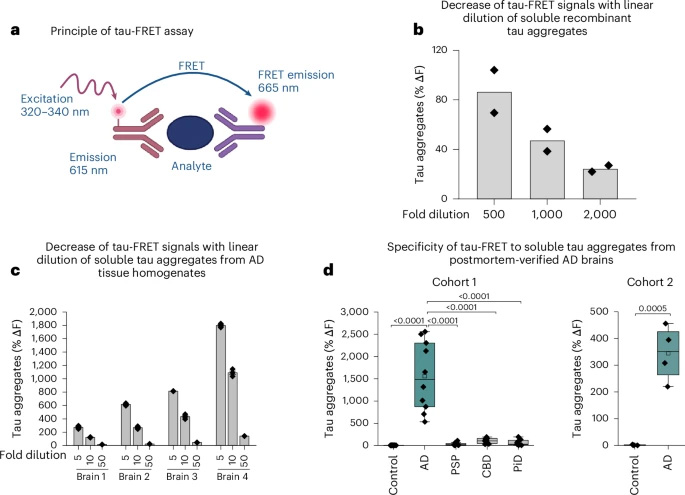
图2 FRET检测的神经病理学验证,该检测特异性识别AD中的STA,但不识别其他神经退行性tau蛋白路径
研究结果
STAs 生化检测方法的验证
通过 FRET 测定法,研究人员发现该方法对 AD 型 STAs 具有特异性。与 α - 突触核蛋白相比,tau 蛋白产生的 FRET 信号更高,且重组 tau 蛋白和 AD 脑额叶灰质组织中 STAs 的 FRET 信号随稀释倍数呈线性下降。在不同 tau 病及对照组的额叶灰质组织检测中,AD 组的 tau - FRET 信号最强,比对照组高约 300 倍,比其他原发性 tau 病高 15 - 43 倍。
AD 脑 STAs 的核心区域
应用 tau - FRET 技术对 AD 脑 STAs 进行生化表征,研究人员发现 STA 核心主要位于 R2 - R4 区域,其核心序列约为 tau 蛋白的 258 - 368 位氨基酸。STA 核心区域在丝氨酸 - 262 和丝氨酸 - 356 处有显著磷酸化。
p - tau Serine-262 和 p - tau Serine-356 在早期 NFTs 检测中的作用
对不同 tau 病理阶段的尸检病例海马 CA1 区进行免疫组化分析,发现 p - tau Serine-262 和 p - tau Serine-356 的免疫染色模式与其他常用 p - tau 抗体不同。在低 Braak NFT 阶段,许多神经元中 p - tau Serine-262 和 p - tau Serine-356 标记局限于部分细胞质;在高 Braak NFT 阶段,这些标记仅在部分神经元中出现。这表明 p - tau Serine-262 和 p - tau Serine-356 可检测早期 NFTs。
STA 核心肽段的体外聚集和功能影响
表达和纯化重组 STA 核心肽段(aa 258 - 368),通过表面等离子共振(SPR)实验和电子显微镜分析,发现 STA 核心肽段比之前鉴定的纤维核心肽段(aa 302 - 368)聚集更快。电生理学实验表明,STA 核心肽段能使神经元静息膜电位显著去极化,增加输入电阻,提高动作电位发放频率,且能显著增加配对脉冲易化程度。
人类 CSF 中 STAs 的检测及临床意义
利用 Simoa 技术开发了检测人类 CSF 中 STAs 的方法。在多个队列中进行临床验证,发现 CSF 中 STA 与总 tau(t - tau)的比值在不同临床诊断和病理诊断组间存在显著差异,与 Braak NFT 分期显著相关。该比值可作为评估 AD 病理进展和认知功能的生物标志物。
研究结论与讨论
研究人员通过整合生化方法,鉴定出 AD 脑中 STAs 的核心肽段(~aa 258 - 368),揭示了 p - tau Serine-262 和 p - tau Serine-356 这两个与聚集相关的磷酸化位点。此外,研究开发了一种检测 CSF 中 tau 前 NFT 病理的生物标志物,并在多个队列中验证了其临床性能。
该研究成果具有多方面重要意义。在诊断方面,新发现的 STA 核心提供了一种可检测非纤维状 tau 物种的 CSF 生物标志物,有助于更准确地诊断 AD。在病理机制研究方面,明确了 STAs 的生化特征和相关磷酸化位点,为开发针对早期 tau 聚集的治疗方法提供了理论基础。此外,对 p - tau Serine-262 和 p - tau Serine-356 的研究表明,它们是 tau 病理的早期指标,可能在 tau 聚集的起始阶段发挥关键作用。未来,基于这些发现开发的生物流体生物标志物检测方法,有望识别出具有原纤维前 tau 病理的个体,推动 AD 机制研究和治疗试验的发展。
参考资料
[1] Phospho-tau serine-262 and serine-356 as biomarkers of pre-tangle soluble tau assemblies in Alzheimer's disease
摘要:p-tau262和p-tau356,检测纤维前tau聚集体的形成。
阿尔茨海默病研究新突破:
来自瑞典哥德堡大学萨尔格伦斯卡学院精神病学和神经化学系等多个单位的研究人员在国际知名期刊《Nature Medicine》上发表了题为“Phospho-tau serine-262 and serine-356 as biomarkers of pre-tangle soluble tau assemblies in Alzheimer’s disease”的论文。该研究在阿尔茨海默病(Alzheimer's Disease, AD)领域具有里程碑意义,为深入理解 AD 早期病理机制、开发新型诊断方法和治疗策略提供了关键线索。
 图1 磷酸化tau丝氨酸-262和丝氨酸-356作为阿尔茨海默病前缠结可溶性tau组装的生物标志物
图1 磷酸化tau丝氨酸-262和丝氨酸-356作为阿尔茨海默病前缠结可溶性tau组装的生物标志物本研究聚焦于阿尔茨海默病早期病理过程中的关键蛋白——tau 蛋白。研究人员通过多种生化方法和临床样本验证,揭示了可溶性 tau 聚集体(Soluble Tau Assemblies, STAs)的核心结构特征及其在脑脊液(Cerebrospinal Fluid, CSF)中的检测方法。研究发现,特定的磷酸化 tau 蛋白(如 p-tau Serine-262 和 p-tau Serine-356)是早期 tau 聚集的关键生物标志物,其在 CSF 中的水平与 AD 病理进展和认知功能障碍密切相关。这一发现不仅为 AD 的早期诊断提供了新的生物标志物,还为开发针对早期 tau 聚集的治疗方法奠定了理论基础。
阿尔茨海默病(AD)是一种以神经原纤维缠结(Neurofibrillary Tangles, NFTs)和淀粉样 β(Amyloid-β, Aβ)斑块为主要病理特征的神经退行性疾病。NFTs 由 tau 蛋白异常聚集形成,其病理严重程度与认知功能障碍的相关性比 Aβ 斑块更强。然而,现有的诊断方法对 NFTs 形成前的早期 tau 变化缺乏敏感性,且针对成熟 tau 纤维的治疗面临诸多挑战。因此,寻找能够检测早期 tau 聚集的生物标志物成为 AD 研究的重要方向。
研究材料
研究使用了人类尸检大脑组织、脑脊液(CSF)样本、重组 tau 蛋白和小鼠等材料。人类大脑组织和 CSF 标本来自多个脑库和研究队列,包括伦敦大学学院皇后广场神经疾病脑库、荷兰脑库和加州大学圣地亚哥分校的 Shiley-Marcos 阿尔茨海默病研究中心(ADRC)等。
研究方法
FRET 测定:利用荧光共振能量转移(FRET)测定法定量人类尸检额叶灰质脑组织中的 STAs。通过将靶向 tau 蛋白特定序列的抗体分别与供体和受体分子偶联,当抗体与多价的 STAs 结合时会产生 FRET 信号,信号强度与 STAs 的数量和大小成正比。
免疫沉淀和质谱分析:使用多种抗 tau 抗体对大脑组织提取物进行免疫沉淀,结合质谱分析(MS)鉴定含有 STA 核心区域的 tau 形式。
免疫组化和免疫荧光:对尸检确诊的 AD 病例海马组织进行免疫组化和免疫荧分析光,检测不同磷酸化 tau 位点的表达和定位。
电生理学实验:制备小鼠海马脑片,孵育不同的重组 tau 肽段,利用全细胞膜片钳记录技术检测神经元的兴奋性和突触传递变化。
CSF 检测方法开发:基于研究发现,利用单分子阵列(Simoa)技术开发检测人类 CSF 中 STAs 的方法,并在多个队列中进行临床验证。

图2 FRET检测的神经病理学验证,该检测特异性识别AD中的STA,但不识别其他神经退行性tau蛋白路径
研究结果
STAs 生化检测方法的验证
通过 FRET 测定法,研究人员发现该方法对 AD 型 STAs 具有特异性。与 α - 突触核蛋白相比,tau 蛋白产生的 FRET 信号更高,且重组 tau 蛋白和 AD 脑额叶灰质组织中 STAs 的 FRET 信号随稀释倍数呈线性下降。在不同 tau 病及对照组的额叶灰质组织检测中,AD 组的 tau - FRET 信号最强,比对照组高约 300 倍,比其他原发性 tau 病高 15 - 43 倍。
AD 脑 STAs 的核心区域
应用 tau - FRET 技术对 AD 脑 STAs 进行生化表征,研究人员发现 STA 核心主要位于 R2 - R4 区域,其核心序列约为 tau 蛋白的 258 - 368 位氨基酸。STA 核心区域在丝氨酸 - 262 和丝氨酸 - 356 处有显著磷酸化。
p - tau Serine-262 和 p - tau Serine-356 在早期 NFTs 检测中的作用
对不同 tau 病理阶段的尸检病例海马 CA1 区进行免疫组化分析,发现 p - tau Serine-262 和 p - tau Serine-356 的免疫染色模式与其他常用 p - tau 抗体不同。在低 Braak NFT 阶段,许多神经元中 p - tau Serine-262 和 p - tau Serine-356 标记局限于部分细胞质;在高 Braak NFT 阶段,这些标记仅在部分神经元中出现。这表明 p - tau Serine-262 和 p - tau Serine-356 可检测早期 NFTs。
STA 核心肽段的体外聚集和功能影响
表达和纯化重组 STA 核心肽段(aa 258 - 368),通过表面等离子共振(SPR)实验和电子显微镜分析,发现 STA 核心肽段比之前鉴定的纤维核心肽段(aa 302 - 368)聚集更快。电生理学实验表明,STA 核心肽段能使神经元静息膜电位显著去极化,增加输入电阻,提高动作电位发放频率,且能显著增加配对脉冲易化程度。
人类 CSF 中 STAs 的检测及临床意义
利用 Simoa 技术开发了检测人类 CSF 中 STAs 的方法。在多个队列中进行临床验证,发现 CSF 中 STA 与总 tau(t - tau)的比值在不同临床诊断和病理诊断组间存在显著差异,与 Braak NFT 分期显著相关。该比值可作为评估 AD 病理进展和认知功能的生物标志物。
研究结论与讨论
研究人员通过整合生化方法,鉴定出 AD 脑中 STAs 的核心肽段(~aa 258 - 368),揭示了 p - tau Serine-262 和 p - tau Serine-356 这两个与聚集相关的磷酸化位点。此外,研究开发了一种检测 CSF 中 tau 前 NFT 病理的生物标志物,并在多个队列中验证了其临床性能。
该研究成果具有多方面重要意义。在诊断方面,新发现的 STA 核心提供了一种可检测非纤维状 tau 物种的 CSF 生物标志物,有助于更准确地诊断 AD。在病理机制研究方面,明确了 STAs 的生化特征和相关磷酸化位点,为开发针对早期 tau 聚集的治疗方法提供了理论基础。此外,对 p - tau Serine-262 和 p - tau Serine-356 的研究表明,它们是 tau 病理的早期指标,可能在 tau 聚集的起始阶段发挥关键作用。未来,基于这些发现开发的生物流体生物标志物检测方法,有望识别出具有原纤维前 tau 病理的个体,推动 AD 机制研究和治疗试验的发展。
参考资料
[1] Phospho-tau serine-262 and serine-356 as biomarkers of pre-tangle soluble tau assemblies in Alzheimer's disease



