摘要:研究人员通过小鼠模型揭示了失调的CD4+ Tcomm细胞从肠道浸润至CNS的核心机制。
肠道微生物组已被证实是多种疾病的关键推手,从炎症性肠病到神经退行性疾病中都观察到菌群组成的显著改变。这些微小住客不仅能通过代谢物入血产生全身影响,更通过激活先天和适应性免疫系统展现免疫调节超能力。但令人困惑的是——在通常无菌的中枢神经系统(CNS)中,肠道菌群如何远程"点火"引发炎症?
 图1 肠道炎症促进微生物群特异性CD4 T细胞介导的神经炎症
图1 肠道炎症促进微生物群特异性CD4 T细胞介导的神经炎症最新研究揭开了这个谜团:当调节性T细胞(Treg)功能缺失时,那些专门识别肠道分节丝状菌(SFB)的CD4+ T细胞会在肠道发炎后"黑化"。这些肠道共生菌特异性T细胞(Tcomm)获得穿越血脑屏障的"通行证",无论其抗原特异性如何都能潜入CNS。更惊人的是,它们能通过分子模拟机制被宿主蛋白质重新激活,瞬间变身"炎症炸弹"大量释放GM-CSF、IFNγ和IL-17A等神经毒性因子。
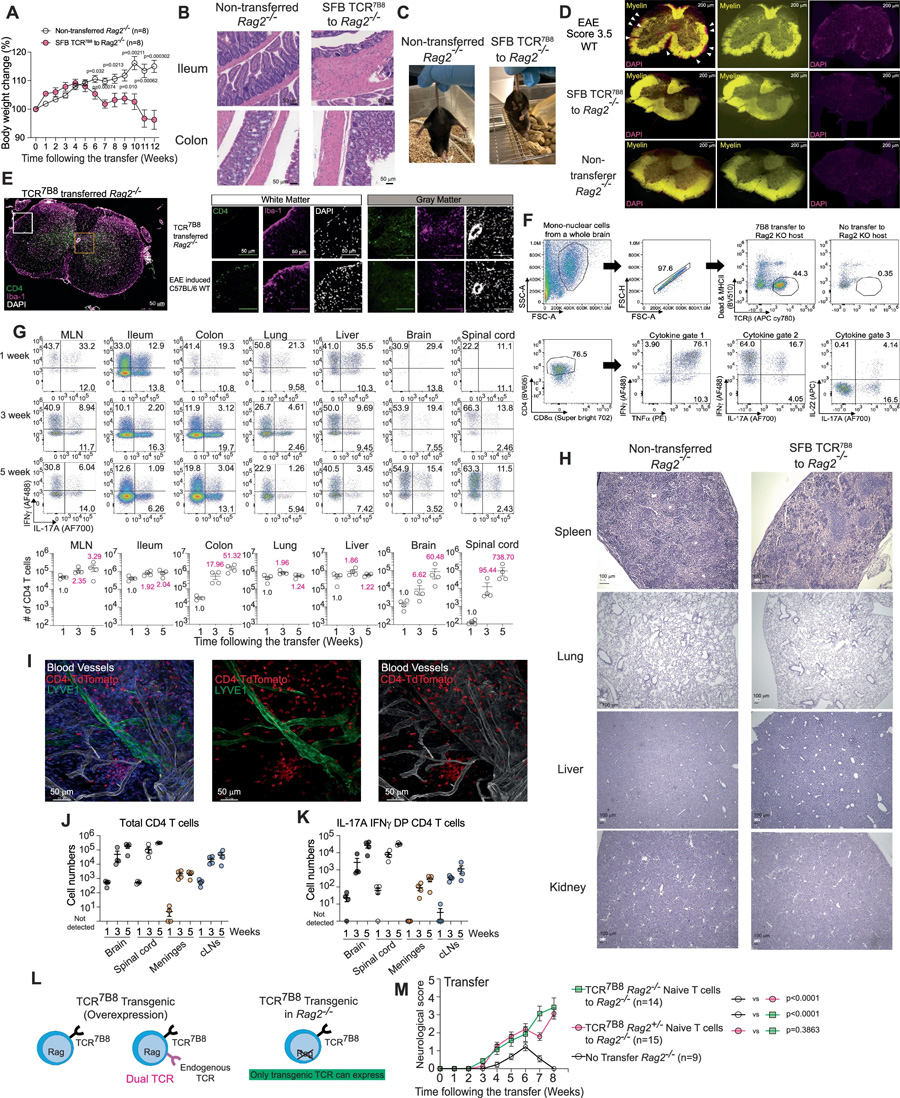
图2 转移的TCR7B8 CD4 T细胞在肠道和中枢神经系统中扩增并展现致病活性
这些"叛变"的Tcomm细胞采用双管齐下的策略搅乱CNS:一方面通过IL-23R依赖性的致脑炎程序,另一方面通过IL-23R非依赖性的GM-CSF生产,共同激活小胶质细胞这支CNS常驻免疫部队。该发现不仅绘制了肠道炎症远程攻击神经系统的分子路线图,更为多发性硬化等肠-脑共患病提供了精准干预靶点。
参考资料
[1] Gut inflammation promotes microbiota-specific CD4 T cell-mediated neuroinflammation
摘要:研究人员通过小鼠模型揭示了失调的CD4+ Tcomm细胞从肠道浸润至CNS的核心机制。
肠道微生物组已被证实是多种疾病的关键推手,从炎症性肠病到神经退行性疾病中都观察到菌群组成的显著改变。这些微小住客不仅能通过代谢物入血产生全身影响,更通过激活先天和适应性免疫系统展现免疫调节超能力。但令人困惑的是——在通常无菌的中枢神经系统(CNS)中,肠道菌群如何远程"点火"引发炎症?
 图1 肠道炎症促进微生物群特异性CD4 T细胞介导的神经炎症
图1 肠道炎症促进微生物群特异性CD4 T细胞介导的神经炎症最新研究揭开了这个谜团:当调节性T细胞(Treg)功能缺失时,那些专门识别肠道分节丝状菌(SFB)的CD4+ T细胞会在肠道发炎后"黑化"。这些肠道共生菌特异性T细胞(Tcomm)获得穿越血脑屏障的"通行证",无论其抗原特异性如何都能潜入CNS。更惊人的是,它们能通过分子模拟机制被宿主蛋白质重新激活,瞬间变身"炎症炸弹"大量释放GM-CSF、IFNγ和IL-17A等神经毒性因子。

图2 转移的TCR7B8 CD4 T细胞在肠道和中枢神经系统中扩增并展现致病活性
这些"叛变"的Tcomm细胞采用双管齐下的策略搅乱CNS:一方面通过IL-23R依赖性的致脑炎程序,另一方面通过IL-23R非依赖性的GM-CSF生产,共同激活小胶质细胞这支CNS常驻免疫部队。该发现不仅绘制了肠道炎症远程攻击神经系统的分子路线图,更为多发性硬化等肠-脑共患病提供了精准干预靶点。
参考资料
[1] Gut inflammation promotes microbiota-specific CD4 T cell-mediated neuroinflammation



