摘要:本研究针对慢性乙型肝炎病毒(HBV)感染导致的肝细胞癌(HCC)问题,通过分析沙特阿拉伯304例HBV基因型D感染者HBsAg序列,发现N103D、Q30K和I208T三个突变在HCC组显著富集。
乙型肝炎病毒(HBV)感染是全球公共卫生重大挑战,每年导致82万人死亡,其中肝细胞癌(HCC)是最致命的并发症。尽管HBV疫苗广泛接种,慢性感染者仍面临HCC风险,其机制涉及病毒变异与宿主互作的复杂过程。特别值得注意的是,HBV表面抗原(HBsAg)作为病毒包膜关键组分,其突变可能通过影响病毒组装、免疫逃逸等途径促进癌变,但基因型D在沙特人群中的突变特征尚未明确。
为解决这一科学问题,沙特阿拉伯国王费萨尔专科医院等机构的研究团队开展了一项突破性研究。通过对304例HBV基因型D感染者(包括180例无症状携带者、62例活动性肝炎、36例肝硬化和26例HCC患者)的全长HBsAg测序分析,结合进化生物学和结构预测技术,首次系统揭示了HBV表面蛋白突变谱与疾病进展的关联。该成果发表于《Gut Pathogens》杂志,为理解HBV致癌机制提供了新视角。
 图1 肝细胞癌患者乙肝病毒表面抗原的突变谱
图1 肝细胞癌患者乙肝病毒表面抗原的突变谱研究采用四项关键技术:1) 多中心回顾性队列构建(样本来自沙特三家医院2007-2011年收集的HBV DNA阳性血清);2) 全长HBsAg基因测序与系统发育分析;3) 基于HyPhy软件的位点特异性选择压力检测(MEME/FEL/SLAC/FUBAR四种模型);4) I-TASSER蛋白质结构预测与表位分析。
突变频率分析
通过5%频率阈值筛选,发现19个高频突变位点。其中N103D(pre-S1区)、Q30K(S蛋白第一胞质域)和I208T(第四跨膜域)在HCC组出现频率显著高于其他组(p<0.05)。引人注目的是,肝硬化组q30k突变完全缺失,提示该位点谷氨酰胺可能具有保护作用。< div="">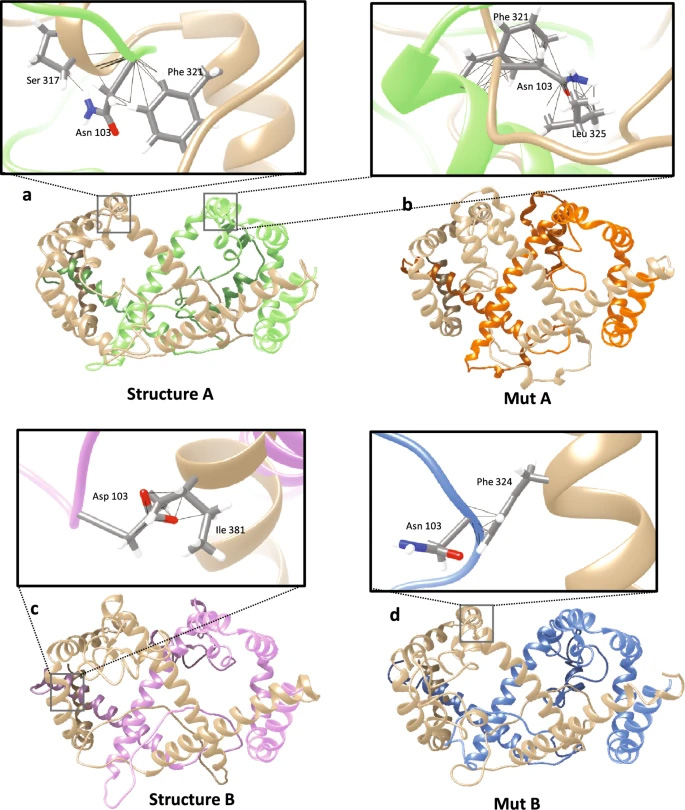
图2 N103D突变对L-HBsAg大蛋白二聚作用的影响
多变量回归分析
调整年龄、BMI等混杂因素后,三突变共存使HCC风险提升25.7倍(95%CI 1.717-810.9)。值得注意的是,年龄增长(OR=1.125)和低BMI(OR=0.821)仍是独立危险因素,但突变组合的效应量远超传统指标。
进化选择特征
全队列分析显示8个S基因位点受正选择,而HCC亚组中N103D、Q30K和I208T均呈现选择信号。特别在P基因重叠区,位点283(对应N103D)和373(对应Q30K)表现出强烈正选择,提示这些突变可能通过影响逆转录酶功能获得适应性优势。

图2 N103D突变对L-HBsAg大蛋白二聚作用的影响
结构功能预测
三维模型显示N103D突变破坏pre-S1-S2交界区(aa 83-110)的B细胞表位(倾向评分从2.388降至-1.079),并影响MHC-I限制性T细胞表位(aa 103-111)呈递。分子对接模拟揭示野生型N103通过范德华力与相邻单体相互作用,而D103突变导致界面结合能丧失,可能改变HBsAg寡聚化模式。
临床意义与讨论
该研究首次在沙特人群中发现HBV表面抗原三位点突变特征:1) N103D位于核衣壳结合域和Hsc70结合位点,可能通过干扰病毒组装和内质网应激途径促癌;2) Q30K影响S蛋白分泌,与隐匿性感染相关;3) I208T改变跨膜域构象,既往在OBI(隐匿性HBV感染)中报道。三者协同作用可能创造更有利的致癌微环境。
从转化医学角度看,这些突变可作为HCC风险分层的补充指标,尤其对肝硬化患者的监测具有预警价值。研究局限性在于横断面设计难以确定因果关系,且缺乏HBsAg定量数据。未来需开展前瞻性队列验证,并探索针对突变株的特异性治疗策略。该成果为理解HBV基因型D的致癌机制开辟了新途径,对中东地区HBV精准防控具有重要指导意义。
参考资料
[1] Mutational landscape of the surface antigen of hepatitis B virus in patients with hepatocellular carcinoma
摘要:本研究针对慢性乙型肝炎病毒(HBV)感染导致的肝细胞癌(HCC)问题,通过分析沙特阿拉伯304例HBV基因型D感染者HBsAg序列,发现N103D、Q30K和I208T三个突变在HCC组显著富集。
乙型肝炎病毒(HBV)感染是全球公共卫生重大挑战,每年导致82万人死亡,其中肝细胞癌(HCC)是最致命的并发症。尽管HBV疫苗广泛接种,慢性感染者仍面临HCC风险,其机制涉及病毒变异与宿主互作的复杂过程。特别值得注意的是,HBV表面抗原(HBsAg)作为病毒包膜关键组分,其突变可能通过影响病毒组装、免疫逃逸等途径促进癌变,但基因型D在沙特人群中的突变特征尚未明确。
为解决这一科学问题,沙特阿拉伯国王费萨尔专科医院等机构的研究团队开展了一项突破性研究。通过对304例HBV基因型D感染者(包括180例无症状携带者、62例活动性肝炎、36例肝硬化和26例HCC患者)的全长HBsAg测序分析,结合进化生物学和结构预测技术,首次系统揭示了HBV表面蛋白突变谱与疾病进展的关联。该成果发表于《Gut Pathogens》杂志,为理解HBV致癌机制提供了新视角。
 图1 肝细胞癌患者乙肝病毒表面抗原的突变谱
图1 肝细胞癌患者乙肝病毒表面抗原的突变谱研究采用四项关键技术:1) 多中心回顾性队列构建(样本来自沙特三家医院2007-2011年收集的HBV DNA阳性血清);2) 全长HBsAg基因测序与系统发育分析;3) 基于HyPhy软件的位点特异性选择压力检测(MEME/FEL/SLAC/FUBAR四种模型);4) I-TASSER蛋白质结构预测与表位分析。
突变频率分析
通过5%频率阈值筛选,发现19个高频突变位点。其中N103D(pre-S1区)、Q30K(S蛋白第一胞质域)和I208T(第四跨膜域)在HCC组出现频率显著高于其他组(p<0.05)。引人注目的是,肝硬化组q30k突变完全缺失,提示该位点谷氨酰胺可能具有保护作用。< div="">
图2 N103D突变对L-HBsAg大蛋白二聚作用的影响
多变量回归分析
调整年龄、BMI等混杂因素后,三突变共存使HCC风险提升25.7倍(95%CI 1.717-810.9)。值得注意的是,年龄增长(OR=1.125)和低BMI(OR=0.821)仍是独立危险因素,但突变组合的效应量远超传统指标。
进化选择特征
全队列分析显示8个S基因位点受正选择,而HCC亚组中N103D、Q30K和I208T均呈现选择信号。特别在P基因重叠区,位点283(对应N103D)和373(对应Q30K)表现出强烈正选择,提示这些突变可能通过影响逆转录酶功能获得适应性优势。

图2 N103D突变对L-HBsAg大蛋白二聚作用的影响
结构功能预测
三维模型显示N103D突变破坏pre-S1-S2交界区(aa 83-110)的B细胞表位(倾向评分从2.388降至-1.079),并影响MHC-I限制性T细胞表位(aa 103-111)呈递。分子对接模拟揭示野生型N103通过范德华力与相邻单体相互作用,而D103突变导致界面结合能丧失,可能改变HBsAg寡聚化模式。
临床意义与讨论
该研究首次在沙特人群中发现HBV表面抗原三位点突变特征:1) N103D位于核衣壳结合域和Hsc70结合位点,可能通过干扰病毒组装和内质网应激途径促癌;2) Q30K影响S蛋白分泌,与隐匿性感染相关;3) I208T改变跨膜域构象,既往在OBI(隐匿性HBV感染)中报道。三者协同作用可能创造更有利的致癌微环境。
从转化医学角度看,这些突变可作为HCC风险分层的补充指标,尤其对肝硬化患者的监测具有预警价值。研究局限性在于横断面设计难以确定因果关系,且缺乏HBsAg定量数据。未来需开展前瞻性队列验证,并探索针对突变株的特异性治疗策略。该成果为理解HBV基因型D的致癌机制开辟了新途径,对中东地区HBV精准防控具有重要指导意义。
参考资料
[1] Mutational landscape of the surface antigen of hepatitis B virus in patients with hepatocellular carcinoma



