摘要:研究揭示了慢性HBV感染中CD4+ Teff细胞通过CD40-CD40L轴激活肝脏库普弗细胞(KCs),促使其分泌IL-12和IL-27,从而逆转HBV特异性CD8+ T细胞功能衰竭的新机制。
慢性乙型肝炎病毒(HBV)感染影响着全球近3亿人,其中相当比例会发展为肝硬化和肝癌。病毒清除主要依赖CD8+细胞毒性T细胞的功能,但在慢性感染中,这些细胞往往陷入"功能衰竭"(exhaustion)状态。尤其令人困惑的是,即使病毒抗原持续存在,为何有些患者能自发清除病毒?先前研究提示CD4+ T细胞的辅助功能可能至关重要,但其具体机制,特别是在肝脏这个特殊免疫微环境中的作用,始终是未解之谜。
意大利圣拉斐尔科学研究所在《Nature Immunology》发表的研究,通过构建HBV特异性CD4+ TCR转基因小鼠(Env126品系),结合多光子活体成像等先进技术,首次揭示了肝脏局部CD4+ T细胞与库普弗细胞(KCs)的三元互动机制。研究发现,效应性CD4+ T细胞(CD4+ Teff)通过CD40-CD40L分子直接激活KCs,促使后者分泌IL-12和IL-27。其中IL-12主要扩增CD4+ T细胞池,而IL-27则是挽救CD8+ T细胞功能的关键因子。这一发现不仅解释了肝脏局部免疫调控的特殊性,还为慢性乙肝的免疫治疗提供了新思路。
 图1 CD4+ T细胞允许库普弗细胞逆转肝细胞启动诱导的CD8+ T细胞功能障碍
图1 CD4+ T细胞允许库普弗细胞逆转肝细胞启动诱导的CD8+ T细胞功能障碍关键技术包括:(1)构建HBV Env126-138特异性CD4+ TCR转基因小鼠;(2)采用rVSVEnv病毒载体在体激活T细胞;(3)多光子活体显微技术观察肝内免疫突触形成;(4)单细胞RNA测序分析T细胞亚群;(5)CLEC4f-iDTR-YFP小鼠进行KCs特异性剔除;(6)慢性乙肝患者PBMCs体外培养验证IL-27的治疗潜力。
CD4+ T细胞逆转CD8+ T细胞功能障碍
通过共转输实验发现,Env126 CD4+ Teff细胞不仅能预防还能逆转由肝细胞抗原提呈诱导的CD8+ T细胞功能障碍。被"拯救"的CD8+ T细胞增殖能力增强,抑制性受体(PD-1、Lag-3、CTLA-4)表达下降,同时效应分子(IFNγ、TNF、Grzm-B)分泌增加。
抗原识别是关键而非表位连锁
研究证实CD4+ T细胞的辅助作用需要直接抗原识别,但不需要与CD8+ T细胞识别的表位物理连接。在MHC-II缺陷小鼠中,CD4+ T细胞无法提供有效帮助,说明TCR-MHC II相互作用不可或缺。
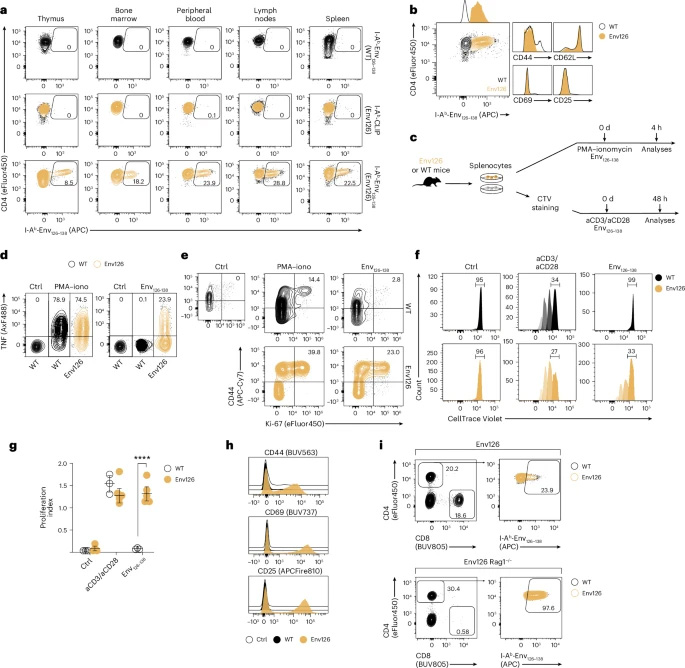
图2 HBV特异性CD4+ TCR转基因小鼠的构建与表征
肝脏局部免疫突触形成
通过阻断淋巴细胞归巢证明,CD4+ T细胞的辅助作用可不依赖次级淋巴器官,直接在肝脏内完成。多光子成像捕捉到CD4+-CD8+-KCs三元稳定互作结构,互作时间超过20分钟,符合免疫突触特征。
库普弗细胞的核心作用
选择性剔除实验显示,KCs而非树突状细胞(DCs)是CD4+ T细胞发挥作用的关键平台。被"许可"(licensed)的KCs高表达MHC II和共刺激分子(CD40、CD80、CD86),并分泌IL-27。
IL-27的治疗潜力
在慢性乙肝患者中,外源性IL-27能显著增强HBV特异性CD8+ T细胞反应,尤其对聚合酶特异性T细胞效果最显著。这为临床转化提供了直接依据。
这项研究颠覆了传统"三细胞"模型认知,提出"肝内许可"新范式:CD4+ Teff→KCs→CD8+ T细胞的级联激活途径。这不仅解释了为何部分慢性感染者能自发控制病毒,更重要的是,IL-27作为可成药靶点,其临床转化风险较低,为开发"功能性治愈"乙肝的新策略奠定了理论基础。研究还暗示,类似机制可能存在于其他慢性病毒感染或肿瘤微环境中,为免疫治疗研究开辟了新方向。
参考资料
[1] CD4+ T cells license Kupffer cells to reverse CD8+ T cell dysfunction induced by hepatocellular priming
摘要:研究揭示了慢性HBV感染中CD4+ Teff细胞通过CD40-CD40L轴激活肝脏库普弗细胞(KCs),促使其分泌IL-12和IL-27,从而逆转HBV特异性CD8+ T细胞功能衰竭的新机制。
慢性乙型肝炎病毒(HBV)感染影响着全球近3亿人,其中相当比例会发展为肝硬化和肝癌。病毒清除主要依赖CD8+细胞毒性T细胞的功能,但在慢性感染中,这些细胞往往陷入"功能衰竭"(exhaustion)状态。尤其令人困惑的是,即使病毒抗原持续存在,为何有些患者能自发清除病毒?先前研究提示CD4+ T细胞的辅助功能可能至关重要,但其具体机制,特别是在肝脏这个特殊免疫微环境中的作用,始终是未解之谜。
意大利圣拉斐尔科学研究所在《Nature Immunology》发表的研究,通过构建HBV特异性CD4+ TCR转基因小鼠(Env126品系),结合多光子活体成像等先进技术,首次揭示了肝脏局部CD4+ T细胞与库普弗细胞(KCs)的三元互动机制。研究发现,效应性CD4+ T细胞(CD4+ Teff)通过CD40-CD40L分子直接激活KCs,促使后者分泌IL-12和IL-27。其中IL-12主要扩增CD4+ T细胞池,而IL-27则是挽救CD8+ T细胞功能的关键因子。这一发现不仅解释了肝脏局部免疫调控的特殊性,还为慢性乙肝的免疫治疗提供了新思路。
 图1 CD4+ T细胞允许库普弗细胞逆转肝细胞启动诱导的CD8+ T细胞功能障碍
图1 CD4+ T细胞允许库普弗细胞逆转肝细胞启动诱导的CD8+ T细胞功能障碍关键技术包括:(1)构建HBV Env126-138特异性CD4+ TCR转基因小鼠;(2)采用rVSVEnv病毒载体在体激活T细胞;(3)多光子活体显微技术观察肝内免疫突触形成;(4)单细胞RNA测序分析T细胞亚群;(5)CLEC4f-iDTR-YFP小鼠进行KCs特异性剔除;(6)慢性乙肝患者PBMCs体外培养验证IL-27的治疗潜力。
CD4+ T细胞逆转CD8+ T细胞功能障碍
通过共转输实验发现,Env126 CD4+ Teff细胞不仅能预防还能逆转由肝细胞抗原提呈诱导的CD8+ T细胞功能障碍。被"拯救"的CD8+ T细胞增殖能力增强,抑制性受体(PD-1、Lag-3、CTLA-4)表达下降,同时效应分子(IFNγ、TNF、Grzm-B)分泌增加。
抗原识别是关键而非表位连锁
研究证实CD4+ T细胞的辅助作用需要直接抗原识别,但不需要与CD8+ T细胞识别的表位物理连接。在MHC-II缺陷小鼠中,CD4+ T细胞无法提供有效帮助,说明TCR-MHC II相互作用不可或缺。

图2 HBV特异性CD4+ TCR转基因小鼠的构建与表征
肝脏局部免疫突触形成
通过阻断淋巴细胞归巢证明,CD4+ T细胞的辅助作用可不依赖次级淋巴器官,直接在肝脏内完成。多光子成像捕捉到CD4+-CD8+-KCs三元稳定互作结构,互作时间超过20分钟,符合免疫突触特征。
库普弗细胞的核心作用
选择性剔除实验显示,KCs而非树突状细胞(DCs)是CD4+ T细胞发挥作用的关键平台。被"许可"(licensed)的KCs高表达MHC II和共刺激分子(CD40、CD80、CD86),并分泌IL-27。
IL-27的治疗潜力
在慢性乙肝患者中,外源性IL-27能显著增强HBV特异性CD8+ T细胞反应,尤其对聚合酶特异性T细胞效果最显著。这为临床转化提供了直接依据。
这项研究颠覆了传统"三细胞"模型认知,提出"肝内许可"新范式:CD4+ Teff→KCs→CD8+ T细胞的级联激活途径。这不仅解释了为何部分慢性感染者能自发控制病毒,更重要的是,IL-27作为可成药靶点,其临床转化风险较低,为开发"功能性治愈"乙肝的新策略奠定了理论基础。研究还暗示,类似机制可能存在于其他慢性病毒感染或肿瘤微环境中,为免疫治疗研究开辟了新方向。
参考资料
[1] CD4+ T cells license Kupffer cells to reverse CD8+ T cell dysfunction induced by hepatocellular priming



