摘要:研究人员揭示了HDAC6通过双重修饰调控ATG3降解的新途径。
来自国内的研究人员针对ATG3蛋白在自噬中的调控机制这一科学问题,揭示了HDAC6通过双重修饰(去乙酰化与K272位泛素化)调控ATG3降解的新途径。该研究阐明了HDAC6兼具去乙酰化酶和E3泛素连接酶活性的独特功能,为自噬相关疾病治疗提供了新靶点。
这项突破性研究揭示了组蛋白去乙酰化酶6(HDAC6)调控细胞自噬的全新分子机制。作为自噬关键执行者,ATG3(自噬相关基因3)这种E2样酶通过调控LC3(微管相关蛋白1A/1B-轻链3)的脂化修饰驱动自噬过程。虽然已知泛素-蛋白酶体途径可降解ATG3,但其精确调控机制始终成谜。

图1 组蛋白去乙酰化酶6通过去乙酰化和泛素化修饰ATG3以调节自噬作用
研究发现HDAC6这个多面手不仅能与ATG3亲密互动,还施展其看家本领——将ATG3蛋白"脱帽"(去乙酰化)。更令人称奇的是,HDAC6竟还暗藏E3泛素连接酶的绝技,专门针对ATG3蛋白第272位赖氨酸(K272)进行泛素化标记,给ATG3贴上"销毁"标签。这个精妙的双重修饰机制如同给ATG3上了双重保险:先摘除乙酰基团,再挂上泛素链条,最终引导ATG3走向蛋白酶体降解的命运。
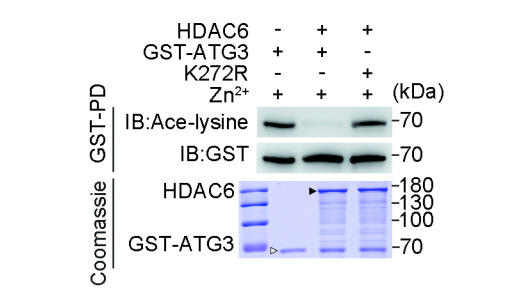
图2 在缺乏持续抗原刺激的条件下,PD-1仍持续表达于小鼠和人类CD8+组织驻留记忆T细胞表面
这项发现不仅揭示了HDAC6在自噬调控中扮演着"分子开关"的重要角色,更开辟了通过靶向蛋白翻译后修饰来干预自噬过程的新思路,为癌症、神经退行性疾病等自噬相关疾病的治疗提供了潜在的新策略。
参考资料
[1] Histone deacetylase 6 deacetylates and ubiquitinates ATG3 to regulate autophagy
摘要:研究人员揭示了HDAC6通过双重修饰调控ATG3降解的新途径。
来自国内的研究人员针对ATG3蛋白在自噬中的调控机制这一科学问题,揭示了HDAC6通过双重修饰(去乙酰化与K272位泛素化)调控ATG3降解的新途径。该研究阐明了HDAC6兼具去乙酰化酶和E3泛素连接酶活性的独特功能,为自噬相关疾病治疗提供了新靶点。
这项突破性研究揭示了组蛋白去乙酰化酶6(HDAC6)调控细胞自噬的全新分子机制。作为自噬关键执行者,ATG3(自噬相关基因3)这种E2样酶通过调控LC3(微管相关蛋白1A/1B-轻链3)的脂化修饰驱动自噬过程。虽然已知泛素-蛋白酶体途径可降解ATG3,但其精确调控机制始终成谜。

图1 组蛋白去乙酰化酶6通过去乙酰化和泛素化修饰ATG3以调节自噬作用
研究发现HDAC6这个多面手不仅能与ATG3亲密互动,还施展其看家本领——将ATG3蛋白"脱帽"(去乙酰化)。更令人称奇的是,HDAC6竟还暗藏E3泛素连接酶的绝技,专门针对ATG3蛋白第272位赖氨酸(K272)进行泛素化标记,给ATG3贴上"销毁"标签。这个精妙的双重修饰机制如同给ATG3上了双重保险:先摘除乙酰基团,再挂上泛素链条,最终引导ATG3走向蛋白酶体降解的命运。

图2 在缺乏持续抗原刺激的条件下,PD-1仍持续表达于小鼠和人类CD8+组织驻留记忆T细胞表面
这项发现不仅揭示了HDAC6在自噬调控中扮演着"分子开关"的重要角色,更开辟了通过靶向蛋白翻译后修饰来干预自噬过程的新思路,为癌症、神经退行性疾病等自噬相关疾病的治疗提供了潜在的新策略。
参考资料
[1] Histone deacetylase 6 deacetylates and ubiquitinates ATG3 to regulate autophagy



