摘要: 本综述深入探讨了免疫代谢在肿瘤微环境(TME)中的关键作用。
诊断与治疗标准的进步显著提高了恶性肿瘤患者的生存率。然而,寻找有效策略以应对耐药性或复发性晚期肿瘤,仍然是一个至关重要且坚定不移的目标。双特异性抗体(BsAbs)通过同时结合两个不同靶点,从而提高了特异性、最大程度减少了脱靶毒性,并能协同调节抗肿瘤免疫和肿瘤微环境,由此开启了抗肿瘤治疗的新时代。与两种单克隆抗体联用相比,BsAbs代表了双特异性的物理整合,展现出更优的结合效力,降低了耐药风险,并实现了独特的生物学功能,例如桥接肿瘤细胞和T细胞以实现精确的细胞毒性作用。然而,诸如脱靶毒性、耐药性和免疫相关不良事件等局限性仍需仔细评估和进一步优化。有必要开展进一步研究,以探索BsAbs与其他抗肿瘤策略联用的潜力,平衡疗效与安全性,并优化基于门诊的给药流程。通过追踪近期获批的BsAbs及处于临床试验阶段的BsAb候选药物的研究进展,可以明显看出,BsAb作为一种新颖且具有变革性的选择,在改善患者生存结局方面拥有巨大前景。
双特异性抗体的分类与作用机制
双特异性抗体(BsAbs)通过同时结合两个不同靶点,展现出超越单克隆抗体的协同效应。从结构上可分为含Fc域的IgG样BsAbs(如cadonilimab)和不含Fc域的非IgG样片段(如BiTE)。作用机制上,桥接型BsAbs(如blinatumomab)通过连接T细胞与肿瘤细胞触发杀伤;抗原交联型(如amivantamab)阻断双信号通路克服耐药;辅因子模拟型(如emicizumab)则替代缺失蛋白功能。

图1 双特异性抗体开启肿瘤治疗新时代
血液肿瘤治疗突破
在急性B淋巴细胞白血病(BCP-ALL)中,CD19×CD3双抗blinatumomab使复发/难治患者中位生存期从4个月提升至7.7个月。针对多发性骨髓瘤(MM),BCMA×CD3双抗teclistamab和GPRC5D×CD3双抗talquetamab在四线治疗中仍能实现60%以上的客观缓解率(ORR)。值得注意的是,glofitamab采用2:1双价CD20结合设计,使弥漫大B细胞淋巴瘤(DLBCL)患者完全缓解(CR)率达39.4%。
实体瘤应用进展
非小细胞肺癌(NSCLC)领域,EGFR×c-MET双抗amivantamab对EGFR 20号外显子插入突变患者的中位无进展生存期(mPFS)达11.4个月。宫颈癌(CC)治疗中,PD-1×CTLA-4四价双抗cadonilimab联合化疗使ORR提升至66.7%。此外,DLL3×CD3双抗tarlatamab为小细胞肺癌(SCLC)后线治疗带来40%的ORR。
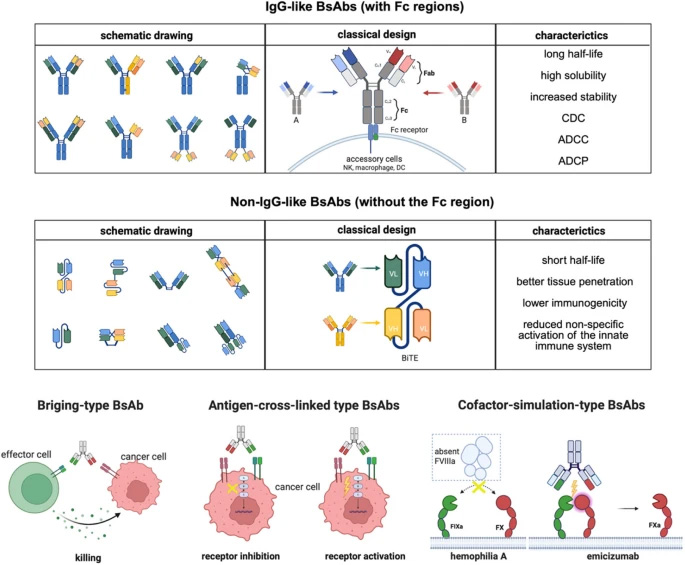
图2 双特异性抗体的分类与作用机制
挑战与优化策略
尽管疗效显著,BsAbs面临CRS(发生率14-35%)、神经毒性(ICANS)和靶向脱瘤效应等挑战。通过阶梯给药(如teclistamab)、皮下注射(如epcoritamab)及Fc工程化改造(如alnuctamab)可降低毒性。针对耐药问题,联合PD-1抑制剂或CAR-T细胞治疗(如CD19 CAR-T序贯blinatumomab)展现出协同潜力。
未来发展方向
当前80%的BsAbs仍处于早期临床阶段,phase III候选药物如PD-L1×TGF-β双抗SHR-1701和HER2×HER3双抗KN026值得关注。随着给药方案优化(如talquetamab每月给药)和门诊管理模式推广,BsAbs有望从"救援治疗"进阶为"全程治疗"支柱。
参考资料
[1] Bispecific antibodies: unleashing a new era in oncology treatment
摘要: 本综述深入探讨了免疫代谢在肿瘤微环境(TME)中的关键作用。
诊断与治疗标准的进步显著提高了恶性肿瘤患者的生存率。然而,寻找有效策略以应对耐药性或复发性晚期肿瘤,仍然是一个至关重要且坚定不移的目标。双特异性抗体(BsAbs)通过同时结合两个不同靶点,从而提高了特异性、最大程度减少了脱靶毒性,并能协同调节抗肿瘤免疫和肿瘤微环境,由此开启了抗肿瘤治疗的新时代。与两种单克隆抗体联用相比,BsAbs代表了双特异性的物理整合,展现出更优的结合效力,降低了耐药风险,并实现了独特的生物学功能,例如桥接肿瘤细胞和T细胞以实现精确的细胞毒性作用。然而,诸如脱靶毒性、耐药性和免疫相关不良事件等局限性仍需仔细评估和进一步优化。有必要开展进一步研究,以探索BsAbs与其他抗肿瘤策略联用的潜力,平衡疗效与安全性,并优化基于门诊的给药流程。通过追踪近期获批的BsAbs及处于临床试验阶段的BsAb候选药物的研究进展,可以明显看出,BsAb作为一种新颖且具有变革性的选择,在改善患者生存结局方面拥有巨大前景。
双特异性抗体的分类与作用机制
双特异性抗体(BsAbs)通过同时结合两个不同靶点,展现出超越单克隆抗体的协同效应。从结构上可分为含Fc域的IgG样BsAbs(如cadonilimab)和不含Fc域的非IgG样片段(如BiTE)。作用机制上,桥接型BsAbs(如blinatumomab)通过连接T细胞与肿瘤细胞触发杀伤;抗原交联型(如amivantamab)阻断双信号通路克服耐药;辅因子模拟型(如emicizumab)则替代缺失蛋白功能。

图1 双特异性抗体开启肿瘤治疗新时代
血液肿瘤治疗突破
在急性B淋巴细胞白血病(BCP-ALL)中,CD19×CD3双抗blinatumomab使复发/难治患者中位生存期从4个月提升至7.7个月。针对多发性骨髓瘤(MM),BCMA×CD3双抗teclistamab和GPRC5D×CD3双抗talquetamab在四线治疗中仍能实现60%以上的客观缓解率(ORR)。值得注意的是,glofitamab采用2:1双价CD20结合设计,使弥漫大B细胞淋巴瘤(DLBCL)患者完全缓解(CR)率达39.4%。
实体瘤应用进展
非小细胞肺癌(NSCLC)领域,EGFR×c-MET双抗amivantamab对EGFR 20号外显子插入突变患者的中位无进展生存期(mPFS)达11.4个月。宫颈癌(CC)治疗中,PD-1×CTLA-4四价双抗cadonilimab联合化疗使ORR提升至66.7%。此外,DLL3×CD3双抗tarlatamab为小细胞肺癌(SCLC)后线治疗带来40%的ORR。

图2 双特异性抗体的分类与作用机制
挑战与优化策略
尽管疗效显著,BsAbs面临CRS(发生率14-35%)、神经毒性(ICANS)和靶向脱瘤效应等挑战。通过阶梯给药(如teclistamab)、皮下注射(如epcoritamab)及Fc工程化改造(如alnuctamab)可降低毒性。针对耐药问题,联合PD-1抑制剂或CAR-T细胞治疗(如CD19 CAR-T序贯blinatumomab)展现出协同潜力。
未来发展方向
当前80%的BsAbs仍处于早期临床阶段,phase III候选药物如PD-L1×TGF-β双抗SHR-1701和HER2×HER3双抗KN026值得关注。随着给药方案优化(如talquetamab每月给药)和门诊管理模式推广,BsAbs有望从"救援治疗"进阶为"全程治疗"支柱。
参考资料
[1] Bispecific antibodies: unleashing a new era in oncology treatment



