摘要:研究建立了首个能完整模拟从初始细胞命运决定到器官发生阶段(E8.5-E8.75)的小鼠胚胎模型(iEFC-EM)。
胚胎发育研究一直是生命科学领域的重大课题,但现有胚胎模型存在效率低、发育阶段有限、保真度不高等瓶颈问题。传统方法需要混合多种干细胞或使用转基因操作,不仅过程复杂,且难以真实模拟自然胚胎发育过程。特别是对于器官发生这一关键发育阶段,现有模型更是难以完整重现。这些局限严重制约了发育生物学研究和再生医学应用。
广州国家实验室的研究人员另辟蹊径,开发了一种全新的研究策略。他们通过精心设计的小分子化合物组合,成功将小鼠胚胎干细胞(ESCs)直接重编程为具有多能性的8-16细胞样胚胎祖细胞(iEFCs)。这些诱导获得的胚胎祖细胞展现出惊人的发育潜力,能够自主形成包含所有囊胚谱系的胚胎模型(iEFC-EM),并首次在体外完整重现了从初始细胞命运决定到器官发生的全过程。这项突破性研究成果发表在顶级期刊《Cell》上。

图1 在化学诱导胚胎祖细胞支持下实现的小鼠胚胎发生至器官发生全过程模型
研究人员运用了多项关键技术:通过小分子化合物筛选建立高效诱导方案;采用单细胞RNA测序(scRNA-seq)分析细胞发育轨迹;利用转座酶可及染色质测序(ATAC-seq)解析表观遗传调控机制;建立优化的胚胎模型培养体系;通过免疫荧光染色和三维成像技术验证模型发育特征。特别值得一提的是,研究还构建了从E1.5到E6.5的小鼠自然胚胎单细胞转录组参考数据集,为模型验证提供了重要基准。
研究结果部分,文章通过系列实验系统验证了iEFC-EM模型的发育保真度:
"Screen identifies small molecules that reprogram ESCs into EFCs"显示,优化的K4处理方案(含CHIR99021、E616452和AM580)可高效诱导ESCs共表达OCT4、GATA6和CDX2,形成分子特征类似8-16细胞期胚胎的iEFCs。单细胞分析证实这些细胞与自然胚胎的转录组特征高度匹配。
"iEFCs segregate all blastocyst lineages both in vivo and in vitro"证实,iEFCs在体内外实验中均能分化为所有囊胚谱系。嵌合实验显示iEFCs可贡献到E6.5胚胎的所有胚层,而单细胞测序进一步验证了其在胚胎和胚外组织中的均衡分布。
"iEFCs specify all blastocyst fates faithfully and rapidly"发现,经过36小时的定向诱导,iEFCs可快速分化为上胚层(EPI)、原始内胚层(PrE)和滋养外胚层(TE),并形成具有极性TE和壁TE特征的复杂结构。
"iEFC-derived embryo model recapitulates embryo development faithfully"展示,iEFC-EM模型在8天内依次重现了谱系特化、腔体形成、对称性打破、原肠形成等关键发育事件,最终形成具有14对体节、跳动心管、神经褶等器官发生期特征的胚胎样结构。
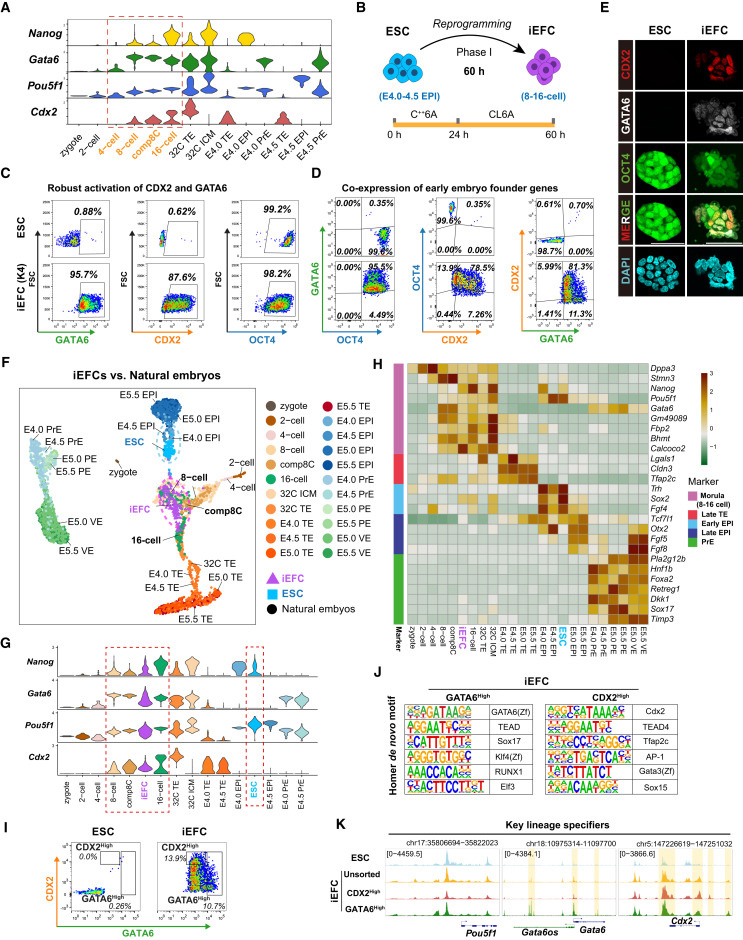
图2 候选分子筛选鉴定出可将胚胎干细胞重编程为类胚胎祖细胞的小分子化合物
"Day-6 iEFC-EMs display high-fidelity E7.5 molecular signature"通过单细胞转录组分析证实,第6天的iEFC-EM与E7.5自然胚胎在分子特征上高度相似,包含24种细胞类型,重现了原条形成、上皮-间质转化(EMT)等原肠胚形成过程。
"iEFC-EMs display advanced trophoblast lineage development"揭示,模型中的胚外组织发育同样高度保真,不仅形成复杂的滋养层亚型,还能诱导子宫蜕膜化,提示其可能分泌未知的母体信号分子。
"iEFC-EMs reach organogenesis efficiently and with high fidelity"显示,第8天的模型形成了包括前/中/后脑、心管、视泡、尾芽等器官原基,单细胞测序鉴定出20种胚胎和7种胚外细胞类型,其转录特征与E8.5自然胚胎高度一致。
"Neurulation and surface ectoderm development"证实,iEFC-EM的神经外胚层发育遵循自然胚胎的时空模式,正确表达了OTX2(前脑和中脑)、PAX6(前脑和后脑)等区域特异性标记。
"Somitogenesis, cardiogenesis and mesodermal development"显示,模型中的体节发生、心脏发育等中胚层衍生物与自然胚胎相似,心管呈现正确的环化形态和收缩功能。
"Endoderm development and PGC progression"发现,模型不仅形成明确的前肠和后肠结构,还产生了正在迁移的原始生殖细胞(PGCs),其分子特征与体内发育的PGCs高度一致。
这项研究在多个方面具有重要意义:首先,iEFC-EM模型首次实现了从干细胞到器官发生阶段的完整胚胎发育过程模拟,为研究早期发育机制提供了全新工具;其次,完全化学小分子诱导的策略避免了转基因操作,更具应用潜力;再者,模型的高效率(54.2%达到器官发生阶段)和可扩展性使其适合大规模筛选应用。特别值得注意的是,研究揭示了胚胎可能通过特定信号分子主动参与母体蜕膜化过程,这一发现为理解胚胎-母体对话提供了新线索。
尽管iEFC-EM模型在发育保真度上取得重大突破,作者也指出了当前局限:模型缺乏与子宫壁接触的壁TE结构,这可能是其难以突破E8.5发育阶段的关键因素。未来研究需要进一步优化培养条件,解析维持后期发育的母体信号,以充分发挥这一系统的应用潜力。这项研究不仅为发育生物学研究树立了新标杆,也为器官再生、疾病建模和生殖医学等领域带来了新的可能性。
参考资料
[1] A complete model of mouse embryogenesis through organogenesis enabled by chemically induced embryo founder cells
摘要:研究建立了首个能完整模拟从初始细胞命运决定到器官发生阶段(E8.5-E8.75)的小鼠胚胎模型(iEFC-EM)。
胚胎发育研究一直是生命科学领域的重大课题,但现有胚胎模型存在效率低、发育阶段有限、保真度不高等瓶颈问题。传统方法需要混合多种干细胞或使用转基因操作,不仅过程复杂,且难以真实模拟自然胚胎发育过程。特别是对于器官发生这一关键发育阶段,现有模型更是难以完整重现。这些局限严重制约了发育生物学研究和再生医学应用。
广州国家实验室的研究人员另辟蹊径,开发了一种全新的研究策略。他们通过精心设计的小分子化合物组合,成功将小鼠胚胎干细胞(ESCs)直接重编程为具有多能性的8-16细胞样胚胎祖细胞(iEFCs)。这些诱导获得的胚胎祖细胞展现出惊人的发育潜力,能够自主形成包含所有囊胚谱系的胚胎模型(iEFC-EM),并首次在体外完整重现了从初始细胞命运决定到器官发生的全过程。这项突破性研究成果发表在顶级期刊《Cell》上。

图1 在化学诱导胚胎祖细胞支持下实现的小鼠胚胎发生至器官发生全过程模型
研究人员运用了多项关键技术:通过小分子化合物筛选建立高效诱导方案;采用单细胞RNA测序(scRNA-seq)分析细胞发育轨迹;利用转座酶可及染色质测序(ATAC-seq)解析表观遗传调控机制;建立优化的胚胎模型培养体系;通过免疫荧光染色和三维成像技术验证模型发育特征。特别值得一提的是,研究还构建了从E1.5到E6.5的小鼠自然胚胎单细胞转录组参考数据集,为模型验证提供了重要基准。
研究结果部分,文章通过系列实验系统验证了iEFC-EM模型的发育保真度:
"Screen identifies small molecules that reprogram ESCs into EFCs"显示,优化的K4处理方案(含CHIR99021、E616452和AM580)可高效诱导ESCs共表达OCT4、GATA6和CDX2,形成分子特征类似8-16细胞期胚胎的iEFCs。单细胞分析证实这些细胞与自然胚胎的转录组特征高度匹配。
"iEFCs segregate all blastocyst lineages both in vivo and in vitro"证实,iEFCs在体内外实验中均能分化为所有囊胚谱系。嵌合实验显示iEFCs可贡献到E6.5胚胎的所有胚层,而单细胞测序进一步验证了其在胚胎和胚外组织中的均衡分布。
"iEFCs specify all blastocyst fates faithfully and rapidly"发现,经过36小时的定向诱导,iEFCs可快速分化为上胚层(EPI)、原始内胚层(PrE)和滋养外胚层(TE),并形成具有极性TE和壁TE特征的复杂结构。
"iEFC-derived embryo model recapitulates embryo development faithfully"展示,iEFC-EM模型在8天内依次重现了谱系特化、腔体形成、对称性打破、原肠形成等关键发育事件,最终形成具有14对体节、跳动心管、神经褶等器官发生期特征的胚胎样结构。

图2 候选分子筛选鉴定出可将胚胎干细胞重编程为类胚胎祖细胞的小分子化合物
"Day-6 iEFC-EMs display high-fidelity E7.5 molecular signature"通过单细胞转录组分析证实,第6天的iEFC-EM与E7.5自然胚胎在分子特征上高度相似,包含24种细胞类型,重现了原条形成、上皮-间质转化(EMT)等原肠胚形成过程。
"iEFC-EMs display advanced trophoblast lineage development"揭示,模型中的胚外组织发育同样高度保真,不仅形成复杂的滋养层亚型,还能诱导子宫蜕膜化,提示其可能分泌未知的母体信号分子。
"iEFC-EMs reach organogenesis efficiently and with high fidelity"显示,第8天的模型形成了包括前/中/后脑、心管、视泡、尾芽等器官原基,单细胞测序鉴定出20种胚胎和7种胚外细胞类型,其转录特征与E8.5自然胚胎高度一致。
"Neurulation and surface ectoderm development"证实,iEFC-EM的神经外胚层发育遵循自然胚胎的时空模式,正确表达了OTX2(前脑和中脑)、PAX6(前脑和后脑)等区域特异性标记。
"Somitogenesis, cardiogenesis and mesodermal development"显示,模型中的体节发生、心脏发育等中胚层衍生物与自然胚胎相似,心管呈现正确的环化形态和收缩功能。
"Endoderm development and PGC progression"发现,模型不仅形成明确的前肠和后肠结构,还产生了正在迁移的原始生殖细胞(PGCs),其分子特征与体内发育的PGCs高度一致。
这项研究在多个方面具有重要意义:首先,iEFC-EM模型首次实现了从干细胞到器官发生阶段的完整胚胎发育过程模拟,为研究早期发育机制提供了全新工具;其次,完全化学小分子诱导的策略避免了转基因操作,更具应用潜力;再者,模型的高效率(54.2%达到器官发生阶段)和可扩展性使其适合大规模筛选应用。特别值得注意的是,研究揭示了胚胎可能通过特定信号分子主动参与母体蜕膜化过程,这一发现为理解胚胎-母体对话提供了新线索。
尽管iEFC-EM模型在发育保真度上取得重大突破,作者也指出了当前局限:模型缺乏与子宫壁接触的壁TE结构,这可能是其难以突破E8.5发育阶段的关键因素。未来研究需要进一步优化培养条件,解析维持后期发育的母体信号,以充分发挥这一系统的应用潜力。这项研究不仅为发育生物学研究树立了新标杆,也为器官再生、疾病建模和生殖医学等领域带来了新的可能性。
参考资料
[1] A complete model of mouse embryogenesis through organogenesis enabled by chemically induced embryo founder cells



