摘要:研究揭示了巨噬细胞在控制志贺氏菌(Shigella)感染中的关键作用。
志贺氏菌(Shigella)是导致细菌性痢疾的主要病原体,每年造成约21.2万人死亡,尤其在儿童和老年人中危害严重。这种细菌通过粪-口途径传播,侵入肠道上皮细胞(IECs)后利用III型分泌系统(T3SS)在胞质内复制,并通过肌动蛋白运动实现细胞间传播。虽然中性粒细胞浸润是志贺氏菌病的典型特征,但长期以来人们对其在感染控制中的确切作用存在争议。更关键的是,尽管大多数健康个体的志贺氏菌感染具有自限性,但宿主如何清除这种主要在上皮细胞内复制的病原体仍不清楚。
传统研究面临两大挑战:一是缺乏合适的动物模型,小鼠对志贺氏菌具有天然抗性;二是虽然已知志贺氏菌能迅速杀死被感染的巨噬细胞,但对未感染"旁观者"巨噬细胞的作用认识不足。为解决这些问题,Kevin D. Eislmayr等研究人员利用新开发的Nlrc4-/-Casp11-/-小鼠模型,系统研究了先天免疫系统控制志贺氏菌感染的机制。这项重要研究成果发表在《Cell Host & Microbe》杂志上。

图1 巨噬细胞通过Toll样受体诱导的白细胞介素12与γ干扰素,协调清除肠上皮细胞微环境中的志贺氏菌
研究人员主要采用了以下关键技术方法:1)建立Nlrc4-/-Casp11-/-小鼠模型模拟人类志贺氏菌病;2)通过抗体中和、基因敲除和骨髓嵌合体实验解析IFN-γ信号通路;3)利用流式细胞术和ELISA分析免疫细胞亚群和细胞因子;4)采用RNA测序技术检测肠上皮细胞基因表达谱;5)使用人类结肠类器官验证关键发现。
研究结果部分包含以下重要发现:
"IFN-γ限制志贺氏菌体内复制并预防严重疾病"部分显示,RNA测序发现感染后肠上皮细胞中干扰素刺激基因(ISGs)显著上调。体外实验证实IFN-γ预处理能抑制志贺氏菌在人结肠类器官和小鼠CT26细胞中的复制。体内实验表明,中和IFN-γ或敲除IFN-γ受体(Ifngr1-/-)会导致小鼠体重严重下降、细菌负荷增加和炎症加剧。
"IFN-γ对非造血细胞的作用至关重要"部分通过骨髓嵌合体实验证明,IFN-γ主要通过作用于辐射抗性(可能为非造血)细胞来限制志贺氏菌。值得注意的是,野生型小鼠中NAIP-NLRC4介导的感染上皮细胞快速排出机制使IFN-γ的作用变得次要,这与人类情况不同,因为人类IECs中NAIP-NLRC4炎症小体功能不全。
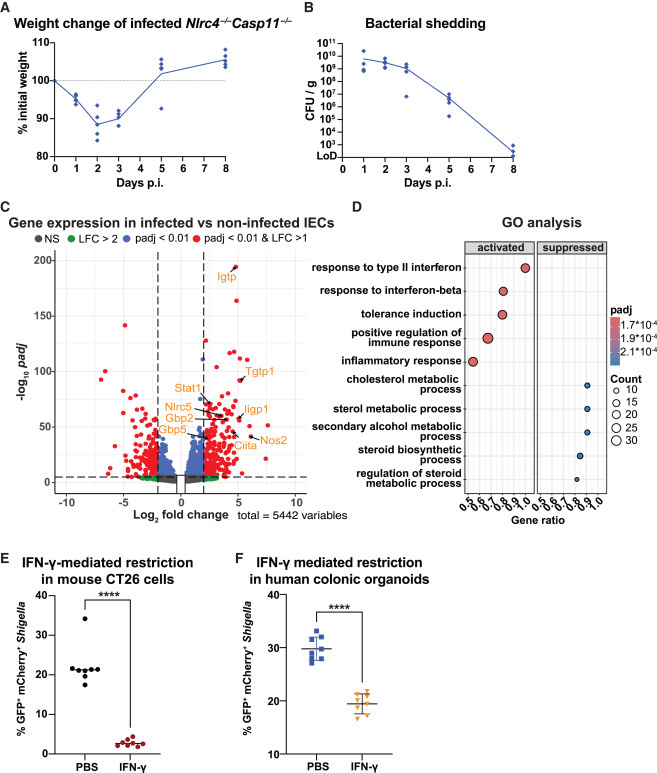
图2 肠上皮细胞中的γ干扰素信号传导与志贺氏菌感染的消退相关
"巨噬细胞对志贺氏菌控制至关重要,但中性粒细胞可有可无"部分得出令人意外的发现:虽然中性粒细胞大量浸润感染组织,但通过抗体或Mrp8Cre/+iDTR条件性清除中性粒细胞对细菌负荷和疾病进程几乎没有影响。相反,使用Lyz2Cre或CD64Cre系统清除巨噬细胞/单核细胞则显著加重感染。
"IFN-γ产生依赖于巨噬细胞TLR感知"部分阐明,巨噬细胞通过TLRs(特别是TLR2/4和Unc93b1依赖性TLRs)感知志贺氏菌,进而产生IL-12。混合骨髓嵌合体实验证实,IL-12的产生需要TLR信号传导和IL-12分泌发生在同一细胞内。
"巨噬细胞来源的IL-12诱导NKp46+和γδT细胞产生IFN-γ"部分利用GREAT IFN-γ报告小鼠鉴定出NK细胞、NKp46+固有淋巴细胞(ILCs)和γδT细胞是IFN-γ的主要来源。IL-12p40中和抗体实验表明,IL-12(而非IL-23)是驱动IFN-γ产生进而控制感染的关键因子。
在讨论部分,作者强调这项研究从根本上改变了人们对志贺氏菌发病机制的认识。主要创新点包括:1)明确了巨噬细胞(而非中性粒细胞)在宿主防御中的核心地位;2)揭示了"旁观者"巨噬细胞通过TLR-IL-12-IFN-γ轴协调抗志贺氏菌免疫的新机制;3)证实IFN-γ直接作用于肠上皮细胞限制细菌复制。尽管志贺氏菌表达IpaH9.8等效应蛋白对抗宿主GBPs等ISGs,但IFN-γ仍能有效控制感染。这些发现不仅解释了志贺氏菌感染的自限性机制,更重要的是为疫苗设计提供了新靶点。
该研究的临床意义在于:人类IECs中NAIP-NLRC4炎症小体功能较弱,使得IFN-γ介导的防御机制可能在人类抗志贺氏菌免疫中扮演更关键角色。此外,研究建立的小鼠模型为后续疫苗和治疗研究提供了宝贵平台。未来研究可进一步明确IFN-γ在人类志贺氏菌病中的作用,并探索如何增强这一通路来预防或治疗感染。
参考资料
[1]Macrophages orchestrate elimination of Shigella from the intestinal epithelial cell niche via TLR-induced IL-12 and IFN-γ
摘要:研究揭示了巨噬细胞在控制志贺氏菌(Shigella)感染中的关键作用。
志贺氏菌(Shigella)是导致细菌性痢疾的主要病原体,每年造成约21.2万人死亡,尤其在儿童和老年人中危害严重。这种细菌通过粪-口途径传播,侵入肠道上皮细胞(IECs)后利用III型分泌系统(T3SS)在胞质内复制,并通过肌动蛋白运动实现细胞间传播。虽然中性粒细胞浸润是志贺氏菌病的典型特征,但长期以来人们对其在感染控制中的确切作用存在争议。更关键的是,尽管大多数健康个体的志贺氏菌感染具有自限性,但宿主如何清除这种主要在上皮细胞内复制的病原体仍不清楚。
传统研究面临两大挑战:一是缺乏合适的动物模型,小鼠对志贺氏菌具有天然抗性;二是虽然已知志贺氏菌能迅速杀死被感染的巨噬细胞,但对未感染"旁观者"巨噬细胞的作用认识不足。为解决这些问题,Kevin D. Eislmayr等研究人员利用新开发的Nlrc4-/-Casp11-/-小鼠模型,系统研究了先天免疫系统控制志贺氏菌感染的机制。这项重要研究成果发表在《Cell Host & Microbe》杂志上。

图1 巨噬细胞通过Toll样受体诱导的白细胞介素12与γ干扰素,协调清除肠上皮细胞微环境中的志贺氏菌
研究人员主要采用了以下关键技术方法:1)建立Nlrc4-/-Casp11-/-小鼠模型模拟人类志贺氏菌病;2)通过抗体中和、基因敲除和骨髓嵌合体实验解析IFN-γ信号通路;3)利用流式细胞术和ELISA分析免疫细胞亚群和细胞因子;4)采用RNA测序技术检测肠上皮细胞基因表达谱;5)使用人类结肠类器官验证关键发现。
研究结果部分包含以下重要发现:
"IFN-γ限制志贺氏菌体内复制并预防严重疾病"部分显示,RNA测序发现感染后肠上皮细胞中干扰素刺激基因(ISGs)显著上调。体外实验证实IFN-γ预处理能抑制志贺氏菌在人结肠类器官和小鼠CT26细胞中的复制。体内实验表明,中和IFN-γ或敲除IFN-γ受体(Ifngr1-/-)会导致小鼠体重严重下降、细菌负荷增加和炎症加剧。
"IFN-γ对非造血细胞的作用至关重要"部分通过骨髓嵌合体实验证明,IFN-γ主要通过作用于辐射抗性(可能为非造血)细胞来限制志贺氏菌。值得注意的是,野生型小鼠中NAIP-NLRC4介导的感染上皮细胞快速排出机制使IFN-γ的作用变得次要,这与人类情况不同,因为人类IECs中NAIP-NLRC4炎症小体功能不全。

图2 肠上皮细胞中的γ干扰素信号传导与志贺氏菌感染的消退相关
"巨噬细胞对志贺氏菌控制至关重要,但中性粒细胞可有可无"部分得出令人意外的发现:虽然中性粒细胞大量浸润感染组织,但通过抗体或Mrp8Cre/+iDTR条件性清除中性粒细胞对细菌负荷和疾病进程几乎没有影响。相反,使用Lyz2Cre或CD64Cre系统清除巨噬细胞/单核细胞则显著加重感染。
"IFN-γ产生依赖于巨噬细胞TLR感知"部分阐明,巨噬细胞通过TLRs(特别是TLR2/4和Unc93b1依赖性TLRs)感知志贺氏菌,进而产生IL-12。混合骨髓嵌合体实验证实,IL-12的产生需要TLR信号传导和IL-12分泌发生在同一细胞内。
"巨噬细胞来源的IL-12诱导NKp46+和γδT细胞产生IFN-γ"部分利用GREAT IFN-γ报告小鼠鉴定出NK细胞、NKp46+固有淋巴细胞(ILCs)和γδT细胞是IFN-γ的主要来源。IL-12p40中和抗体实验表明,IL-12(而非IL-23)是驱动IFN-γ产生进而控制感染的关键因子。
在讨论部分,作者强调这项研究从根本上改变了人们对志贺氏菌发病机制的认识。主要创新点包括:1)明确了巨噬细胞(而非中性粒细胞)在宿主防御中的核心地位;2)揭示了"旁观者"巨噬细胞通过TLR-IL-12-IFN-γ轴协调抗志贺氏菌免疫的新机制;3)证实IFN-γ直接作用于肠上皮细胞限制细菌复制。尽管志贺氏菌表达IpaH9.8等效应蛋白对抗宿主GBPs等ISGs,但IFN-γ仍能有效控制感染。这些发现不仅解释了志贺氏菌感染的自限性机制,更重要的是为疫苗设计提供了新靶点。
该研究的临床意义在于:人类IECs中NAIP-NLRC4炎症小体功能较弱,使得IFN-γ介导的防御机制可能在人类抗志贺氏菌免疫中扮演更关键角色。此外,研究建立的小鼠模型为后续疫苗和治疗研究提供了宝贵平台。未来研究可进一步明确IFN-γ在人类志贺氏菌病中的作用,并探索如何增强这一通路来预防或治疗感染。
参考资料
[1]Macrophages orchestrate elimination of Shigella from the intestinal epithelial cell niche via TLR-induced IL-12 and IFN-γ



