摘要:研究团队针对DNA病毒感染中天然免疫应答"静默-激活"转换的调控机制展开研究,发现SCF E3泛素连接酶复合物的底物识别组分FBXW7通过双重调控机制。
当DNA病毒入侵时,环鸟苷酸-腺苷酸合成酶(cGAS)会识别病毒DNA,进而通过MITA(又称STING)触发I型干扰素(IFN-I)等细胞因子的产生。这些IFN-I进一步激活STAT1/2信号转导,诱导干扰素刺激基因(ISGs)表达并启动天然抗病毒反应。但科学家们一直困惑:未感染细胞如何维持免疫静默状态?感染后又如何快速激活应答?

图1 FBXW7是DNA病毒引发的天然免疫应答的多功能调节因子
这项研究揭示了FBXW7——SCF E3泛素连接酶复合物的关键组分,在DNA病毒天然免疫中的精妙调控机制。在静息状态下,FBXW7通过双重刹车机制:一方面在高尔基体降解被GSK3α/β磷酸化的转运蛋白SLC35B2/3,减少硫酸化糖胺聚糖(sGAGs)的生成,使MITA保持休眠;另一方面清除GSK3α/β磷酸化的转录抑制因子MYC,确保STAT1/2维持在备战水平。这种差异调控使细胞处于"箭在弦上"的警戒状态。
当病毒来袭时,PI3K-AKT信号通路迅速激活,抑制GSK3α/β的活性。这直接解除了FBXW7对SLC35B2/3的降解作用,促使高尔基体大量产生sGAGs,进而激活MITA并启动抗病毒应答。研究团队在THP-1人源细胞和小鼠骨髓巨噬细胞(BMDM)中的基因敲除实验完美验证了这一调控机制。
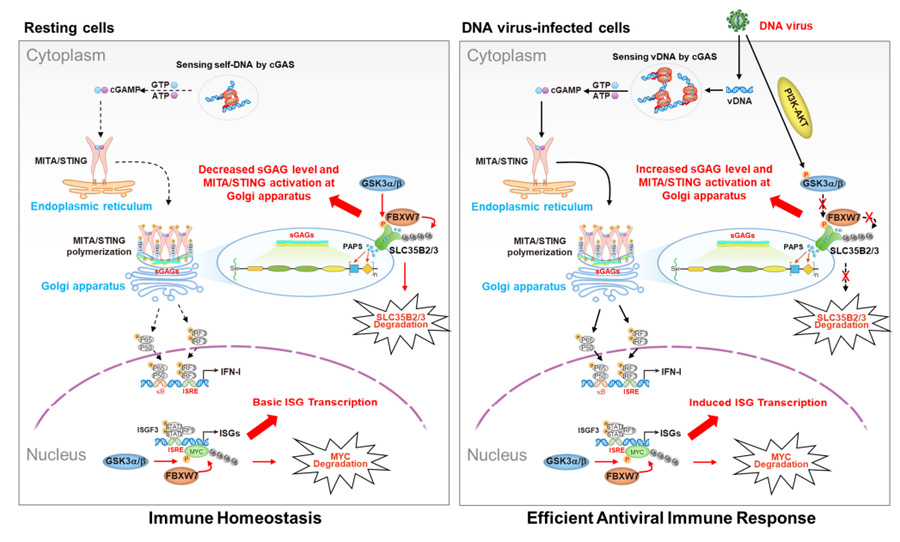
图2 GSK3α/β-FBXW7分子轴调控MITA/STING蛋白活性及下游I型干扰素应答通路的作用机制模型
这项突破性发现首次阐明FBXW7如同精密的"免疫开关",通过差异调控I型干扰素环路的上游(MITA)和下游(STAT1/2)元件,实现天然免疫应答的精准时空调控,为抗DNA病毒治疗提供了新的靶点策略。
参考资料
[1] FBXW7 is a multifaceted regulator of the innate immune response to DNA viruses
摘要:研究团队针对DNA病毒感染中天然免疫应答"静默-激活"转换的调控机制展开研究,发现SCF E3泛素连接酶复合物的底物识别组分FBXW7通过双重调控机制。
当DNA病毒入侵时,环鸟苷酸-腺苷酸合成酶(cGAS)会识别病毒DNA,进而通过MITA(又称STING)触发I型干扰素(IFN-I)等细胞因子的产生。这些IFN-I进一步激活STAT1/2信号转导,诱导干扰素刺激基因(ISGs)表达并启动天然抗病毒反应。但科学家们一直困惑:未感染细胞如何维持免疫静默状态?感染后又如何快速激活应答?

图1 FBXW7是DNA病毒引发的天然免疫应答的多功能调节因子
这项研究揭示了FBXW7——SCF E3泛素连接酶复合物的关键组分,在DNA病毒天然免疫中的精妙调控机制。在静息状态下,FBXW7通过双重刹车机制:一方面在高尔基体降解被GSK3α/β磷酸化的转运蛋白SLC35B2/3,减少硫酸化糖胺聚糖(sGAGs)的生成,使MITA保持休眠;另一方面清除GSK3α/β磷酸化的转录抑制因子MYC,确保STAT1/2维持在备战水平。这种差异调控使细胞处于"箭在弦上"的警戒状态。
当病毒来袭时,PI3K-AKT信号通路迅速激活,抑制GSK3α/β的活性。这直接解除了FBXW7对SLC35B2/3的降解作用,促使高尔基体大量产生sGAGs,进而激活MITA并启动抗病毒应答。研究团队在THP-1人源细胞和小鼠骨髓巨噬细胞(BMDM)中的基因敲除实验完美验证了这一调控机制。

图2 GSK3α/β-FBXW7分子轴调控MITA/STING蛋白活性及下游I型干扰素应答通路的作用机制模型
这项突破性发现首次阐明FBXW7如同精密的"免疫开关",通过差异调控I型干扰素环路的上游(MITA)和下游(STAT1/2)元件,实现天然免疫应答的精准时空调控,为抗DNA病毒治疗提供了新的靶点策略。
参考资料
[1] FBXW7 is a multifaceted regulator of the innate immune response to DNA viruses



