病毒疫苗的研发与生产是一场与时间赛跑的科技战役,而其核心与瓶颈在于大规模、高效、稳定的细胞培养和病毒扩增工艺。在病毒疫苗生产中,细胞是病毒复制的 “宿主工厂”,细胞培养工艺的优劣直接决定后续病毒扩增效率。从传统的鸡胚、原代细胞到如今广泛应用的连续传代细胞系(如Vero、MDCK细胞),细胞基质的选择直接影响病毒的适配性和扩增能力)。优化方向包括寻找更高效、更安全、无动物源成分的细胞培养体系。
西宝生物科技(上海)是一家专注于生命科学和生物技术领域的高科技企业,其业务覆盖了从研发到生产的多个环节。在病毒疫苗领域,西宝生物并非直接从事成品疫苗的开发和生产,而是定位于关键的上游供应商和技术服务伙伴,为疫苗研发和生产机构(如CXO企业、生物制药公司、科研院所)提供核心原材料、试剂、技术平台及解决方案。
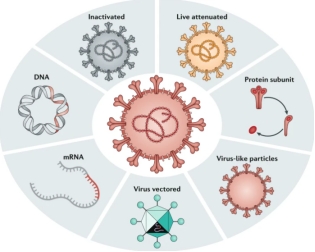
病毒疫苗类型
一、 主要病毒疫苗技术平台
1. 灭活疫苗 (Inactivated Virus Vaccine)
灭活疫苗是通过物理或化学方法将病毒灭活后制成的疫苗,是最成熟的疫苗开发技术。目前已成功研发并广泛使用的产品包括甲肝灭活疫苗、手足口病灭活疫苗、脊髓灰质炎灭活疫苗等。
优点:技术成熟、可利用现有生产条件快速开发、稳定性好、安全性高(无复制能力)。
挑战:免疫原性相对较弱,通常需要佐剂并多次接种;诱导的细胞免疫反应较弱;可能存在抗体依赖性增强(ADE)效应的风险。
2. 减毒活疫苗 (Live Attenuated Vaccine)
减毒活疫苗是通过一定方式处理病毒,获得毒力减弱的毒株后制成的疫苗。目前广泛使用的麻疹疫苗就是减毒活疫苗。
优点:通常能诱导强烈的、持久的体液免疫和细胞免疫,模拟自然感染过程,保护效果通常很好。
挑战:对于免疫力低下的人群可能存在致病风险;有毒力回复的极小可能性;通常需要冷藏,运输储存要求较高。
3. 亚单位疫苗/重组蛋白疫苗 (Subunit Vaccine)
亚单位疫苗是利用基因工程技术,生产病毒中最可能作为抗原的蛋白亚单位制成的疫苗。目前已成功研发的产品包括乙肝疫苗、宫颈癌(HPV)疫苗等。
优点:成分明确,安全性高,研发工艺成熟,可大规模生产。
挑战:免疫原性较弱,需要佐剂和多次接种;激活CD8+ T细胞免疫的效果弱;若使用铝佐剂,免疫反应可能偏向Th2型,不适合呼吸道黏膜接种。
4. 病毒样颗粒疫苗 (Virus-Like Particle Vaccine, VLP)
病毒样颗粒是由多个病毒蛋白自发组装形成的、在结构上高度模拟真实病毒但缺乏病毒基因组的颗粒。市场上的多种乙肝疫苗和HPV疫苗都属于VLP疫苗。
优点:具有病毒的高度结构相似性,因此免疫原性很强,能有效诱导高效的中和抗体;不含遗传物质,非常安全。
挑战:生产工艺复杂,组装和纯化步骤要求高,成本相对较高。
5. 重组病毒载体疫苗 (Recombinant Viral Vector Vaccine)
该技术利用经过基因工程改造的病毒(如腺病毒)作为载体,携带目标病毒抗原的基因。接种后,载体病毒在人体内感染细胞并表达抗原蛋白,从而引发免疫反应。
优点:能诱导强烈的细胞免疫;通常无需佐剂;一些载体(如ChAdOx)可单次接种并提供保护;适合开发黏膜疫苗;生产周期短。
挑战:若人体已对载体病毒存在预存免疫力,可能会削弱疫苗效果。
6. 核酸疫苗 (Nucleic Acid Vaccine)
包括DNA疫苗和mRNA疫苗。其原理是将编码病毒抗原的遗传物质(DNA或mRNA)直接导入人体细胞,利用人体细胞自身的机器来生产抗原蛋白,从而激发免疫反应。mRNA疫苗在新冠疫情期间大放异彩。
优点:
研发速度快:平台化技术,一旦获得病原体基因序列即可快速设计疫苗。
安全性高:不含病毒成分,无感染风险。
免疫效果好:能诱导全面的体液免疫和T细胞免疫。
挑战:mRNA疫苗的脂质纳米颗粒(LNP)递送系统需要低温储存;长期安全性数据仍在积累中。
病毒疫苗生产环节
核心生产环节 | 灭活疫苗 | 减毒活疫苗 | 病毒载体疫苗(如腺病毒载体) | 重组蛋白疫苗(如亚单位疫苗) | mRNA 疫苗 | DNA 疫苗 |
1. 病毒种子制备 | 分离、鉴定目标病毒株,在细胞或鸡胚中扩增培养 | 分离目标病毒株,通过传代等方式人工减毒 | 将目标病毒抗原基因插入载体病毒 | 无活病毒参与 | 无活病毒参与 | 无活病毒参与 |
2. 大规模生产抗原 | 在生物反应器(细胞工厂 / 鸡胚)中大规模培养活病毒 | 在生物反应器 中大规模培养减毒活病毒 | 在特定细胞系中培养重组载体病毒 | 在工程细胞 (酵母、昆虫细胞 / 动物细胞) 中表达目标抗原蛋白 | 体外合成目标抗原的 mRNA 序列 | 体外合成编码目标抗原的 DNA 质粒 |
3. 收获与初步纯化 | 收获含病毒培养液,离心 / 过滤去除大颗粒杂质 | 收获含病毒培养液,离心 / 过滤去除大颗粒杂质 | 收获含病毒载体培养液,离心过滤 | 收获细胞培养液或裂解液,分离目标蛋白 | 收获反应液,进行初步纯化 | 收获细菌培养物,提取纯化质粒 DNA |
4. 灭活 / 减毒确认识裂 | 使用化学试剂 (甲醛 /β 丙内酯) 彻底灭活病毒活性 | 严格检测确保减毒稳定性和安全性 | 通常不需要额外灭活 | 无活病毒 | 无活病毒 | 无活病毒 |
5. 高度纯化 | 超滤和层析等色谱技术去除杂质 (细胞碎片、培养基成分、灭活剂) | 类似灭活疫苗纯化 | 类似灭活疫苗纯化,去除宿主细胞 DNA / 蛋白 | 多步层析和过滤获得高纯度蛋白 | 去除杂质 (酶、DNA 模板、有机溶剂等),获得纯净 mRNA | 去除内毒素、宿主杂质等,获得高纯度质粒 |
6. 制剂 | 缓冲液复溶纯化病毒,可能添加佐剂 (如铝佐剂) 增强免疫应答 | 缓冲液复溶纯化病毒,通常不加佐剂 | 缓冲液复溶纯化病毒载体 | 纯化蛋白 + 佐剂 (如铝佐剂) 混合 | mRNA 包裹入脂质纳米颗粒 (LNP),形成保护性递送系统 | 缓冲液溶解质粒 DNA |
疫苗研究实例
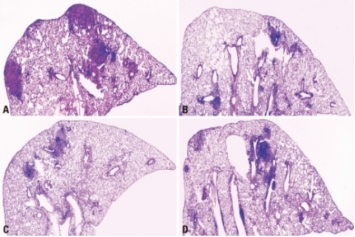
经强毒结核分枝杆菌气溶胶感染后的肺部组织病理学表现
卡介苗(BCG)可诱导高水平的γ干扰素(IFN-γ),但与单独接种BCG相比,联合接种IL-12或IL-18 DNA疫苗构建体与BCG能诱导显著更高水平的IFN-γ。BCG在结核分枝杆菌感染早期具有高度保护作用,但在感染后期其保护效力会降低。与单独使用BCG相比,联合接种IL-12 DNA疫苗构建体与BCG在感染早期保护效果略有增强,在感染后期则显示出显著更强的保护效力。
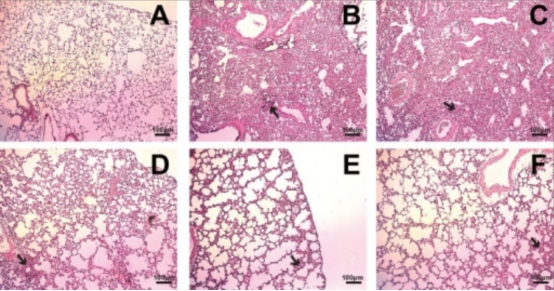
灭活EV71疫苗在SCARB2转基因小鼠模型中展现交叉保护效力
疫苗接种显著降低了转基因小鼠中枢神经系统内的病毒抗原载量;有效缓解了病毒引发的炎症反应。实验结果表明,该微载体/生物反应器平台制备的疫苗具有显著免疫保护效果,其综合性能优于传统转瓶培养系统。
选择依据
培养基选择:Vero细胞培养基适合贴壁培养,MDCK培养基更适合悬浮流感病毒生产。
稳定剂差异:海藻糖适合干燥保存,人血白蛋白用于液态疫苗稳定性提升。
灭活剂对比:β-丙内酯优于甲醛的残留安全性,Triton X-100需注意环境毒性。
推荐产品
类别 | 产品 | 适用场景 | |
病毒增殖培养基 | VeroSFM | 无血清无动物源,化学成分限定,GMP标准生产,适合大规模工业化疫苗生产 | |
Vero VM (病毒维持液) | 无血清无动物源,支持Vero细胞贴壁培养,适用于狂犬病、乙脑等疫苗生产 | ||
MDCK SFM | 无血清无动物源悬浮培养基,支持MDCK细胞高密度培养,用于流感疫苗生产 | ||
病毒稳定剂 | ACJ1857A | 药用级海藻糖 | 非还原性稳定剂,保护病毒活性,可常温保存生物制品 |
ACJ0073B | 蔗糖 | 用于病毒纯化密度梯度离心,RNase/DNase Free | |
DCL0119D | 人血白蛋白 | 高浓度白蛋白,作为疫苗稳定剂,防止蛋白变性 | |
病毒灭活试剂 | AJL0175F | β-丙内酯(BPL) | 作用于病毒核酸,灭活时间短,水解产物无毒,适用于狂犬病等疫苗 |
ACH0026Q | Triton X-100 | 非离子去垢剂,破坏脂质膜灭活包膜病毒,适用于生物制品灭活 | |
疫苗佐剂 | AEI0021I | 氢氧化铝佐剂 | 促进体液免疫(抗体)反应和TH2类细胞免疫反应;用于疫苗和兽用疫苗。 |
参考文献
[1]. Jeon BY, et al.Co-immunization of plasmid DNA encoding IL-12 and IL-18 with Bacillus Calmette-Guérin vaccine against progressive tuberculosis.Yonsei medical journal(2011)
[2]. Choi HJ, et al. Effect of AcHERV-GmCSF as an Influenza Virus Vaccine Adjuvant. PloS one(2015)
病毒疫苗的研发与生产是一场与时间赛跑的科技战役,而其核心与瓶颈在于大规模、高效、稳定的细胞培养和病毒扩增工艺。在病毒疫苗生产中,细胞是病毒复制的“宿主工厂”,细胞培养工艺的优劣直接决定后续病毒扩增效率。从传统的鸡胚、原代细胞到如今广泛应用的连续传代细胞系(如Vero、MDCK细胞),细胞基质的选择直接影响病毒的适配性和扩增能力)。优化方向包括寻找更高效、更安全、无动物源成分的细胞培养体系。
西宝生物科技(上海)是一家专注于生命科学和生物技术领域的高科技企业,其业务覆盖了从研发到生产的多个环节。在病毒疫苗领域,西宝生物并非直接从事成品疫苗的开发和生产,而是定位于关键的上游供应商和技术服务伙伴,为疫苗研发和生产机构(如CXO企业、生物制药公司、科研院所)提供核心原材料、试剂、技术平台及解决方案。

病毒疫苗类型
一、 主要病毒疫苗技术平台
1. 灭活疫苗 (Inactivated Virus Vaccine)
灭活疫苗是通过物理或化学方法将病毒灭活后制成的疫苗,是最成熟的疫苗开发技术。目前已成功研发并广泛使用的产品包括甲肝灭活疫苗、手足口病灭活疫苗、脊髓灰质炎灭活疫苗等。
优点:技术成熟、可利用现有生产条件快速开发、稳定性好、安全性高(无复制能力)。
挑战:免疫原性相对较弱,通常需要佐剂并多次接种;诱导的细胞免疫反应较弱;可能存在抗体依赖性增强(ADE)效应的风险。
2. 减毒活疫苗 (Live Attenuated Vaccine)
减毒活疫苗是通过一定方式处理病毒,获得毒力减弱的毒株后制成的疫苗。目前广泛使用的麻疹疫苗就是减毒活疫苗。
优点:通常能诱导强烈的、持久的体液免疫和细胞免疫,模拟自然感染过程,保护效果通常很好。
挑战:对于免疫力低下的人群可能存在致病风险;有毒力回复的极小可能性;通常需要冷藏,运输储存要求较高。
3. 亚单位疫苗/重组蛋白疫苗 (Subunit Vaccine)
亚单位疫苗是利用基因工程技术,生产病毒中最可能作为抗原的蛋白亚单位制成的疫苗。目前已成功研发的产品包括乙肝疫苗、宫颈癌(HPV)疫苗等。
优点:成分明确,安全性高,研发工艺成熟,可大规模生产。
挑战:免疫原性较弱,需要佐剂和多次接种;激活CD8+ T细胞免疫的效果弱;若使用铝佐剂,免疫反应可能偏向Th2型,不适合呼吸道黏膜接种。
4. 病毒样颗粒疫苗 (Virus-Like Particle Vaccine, VLP)
病毒样颗粒是由多个病毒蛋白自发组装形成的、在结构上高度模拟真实病毒但缺乏病毒基因组的颗粒。市场上的多种乙肝疫苗和HPV疫苗都属于VLP疫苗。
优点:具有病毒的高度结构相似性,因此免疫原性很强,能有效诱导高效的中和抗体;不含遗传物质,非常安全。
挑战:生产工艺复杂,组装和纯化步骤要求高,成本相对较高。
5. 重组病毒载体疫苗 (Recombinant Viral Vector Vaccine)
该技术利用经过基因工程改造的病毒(如腺病毒)作为载体,携带目标病毒抗原的基因。接种后,载体病毒在人体内感染细胞并表达抗原蛋白,从而引发免疫反应。
优点:能诱导强烈的细胞免疫;通常无需佐剂;一些载体(如ChAdOx)可单次接种并提供保护;适合开发黏膜疫苗;生产周期短。
挑战:若人体已对载体病毒存在预存免疫力,可能会削弱疫苗效果。
6. 核酸疫苗 (Nucleic Acid Vaccine)
包括DNA疫苗和mRNA疫苗。其原理是将编码病毒抗原的遗传物质(DNA或mRNA)直接导入人体细胞,利用人体细胞自身的机器来生产抗原蛋白,从而激发免疫反应。mRNA疫苗在新冠疫情期间大放异彩。
优点:
研发速度快:平台化技术,一旦获得病原体基因序列即可快速设计疫苗。
安全性高:不含病毒成分,无感染风险。
免疫效果好:能诱导全面的体液免疫和T细胞免疫。
挑战:mRNA疫苗的脂质纳米颗粒(LNP)递送系统需要低温储存;长期安全性数据仍在积累中。
病毒疫苗生产环节
核心生产环节 | 灭活疫苗 | 减毒活疫苗 | 病毒载体疫苗(如腺病毒载体) | 重组蛋白疫苗(如亚单位疫苗) | mRNA 疫苗 | DNA 疫苗 |
1. 病毒种子制备 | 分离、鉴定目标病毒株,在细胞或鸡胚中扩增培养 | 分离目标病毒株,通过传代等方式人工减毒 | 将目标病毒抗原基因插入载体病毒 | 无活病毒参与 | 无活病毒参与 | 无活病毒参与 |
2. 大规模生产抗原 | 在生物反应器(细胞工厂 / 鸡胚)中大规模培养活病毒 | 在生物反应器 中大规模培养减毒活病毒 | 在特定细胞系中培养重组载体病毒 | 在工程细胞 (酵母、昆虫细胞 / 动物细胞) 中表达目标抗原蛋白 | 体外合成目标抗原的 mRNA 序列 | 体外合成编码目标抗原的 DNA 质粒 |
3. 收获与初步纯化 | 收获含病毒培养液,离心 / 过滤去除大颗粒杂质 | 收获含病毒培养液,离心 / 过滤去除大颗粒杂质 | 收获含病毒载体培养液,离心过滤 | 收获细胞培养液或裂解液,分离目标蛋白 | 收获反应液,进行初步纯化 | 收获细菌培养物,提取纯化质粒 DNA |
4. 灭活 / 减毒确认识裂 | 使用化学试剂 (甲醛 /β 丙内酯) 彻底灭活病毒活性 | 严格检测确保减毒稳定性和安全性 | 通常不需要额外灭活 | 无活病毒 | 无活病毒 | 无活病毒 |
5. 高度纯化 | 超滤和层析等色谱技术去除杂质 (细胞碎片、培养基成分、灭活剂) | 类似灭活疫苗纯化 | 类似灭活疫苗纯化,去除宿主细胞 DNA / 蛋白 | 多步层析和过滤获得高纯度蛋白 | 去除杂质 (酶、DNA 模板、有机溶剂等),获得纯净 mRNA | 去除内毒素、宿主杂质等,获得高纯度质粒 |
6. 制剂 | 缓冲液复溶纯化病毒,可能添加佐剂 (如铝佐剂) 增强免疫应答 | 缓冲液复溶纯化病毒,通常不加佐剂 | 缓冲液复溶纯化病毒载体 | 纯化蛋白 + 佐剂 (如铝佐剂) 混合 | mRNA 包裹入脂质纳米颗粒 (LNP),形成保护性递送系统 | 缓冲液溶解质粒 DNA |
疫苗研究实例

经强毒结核分枝杆菌气溶胶感染后的肺部组织病理学表现
卡介苗(BCG)可诱导高水平的γ干扰素(IFN-γ),但与单独接种BCG相比,联合接种IL-12或IL-18 DNA疫苗构建体与BCG能诱导显著更高水平的IFN-γ。BCG在结核分枝杆菌感染早期具有高度保护作用,但在感染后期其保护效力会降低。与单独使用BCG相比,联合接种IL-12 DNA疫苗构建体与BCG在感染早期保护效果略有增强,在感染后期则显示出显著更强的保护效力。

灭活EV71疫苗在SCARB2转基因小鼠模型中展现交叉保护效力
疫苗接种显著降低了转基因小鼠中枢神经系统内的病毒抗原载量;有效缓解了病毒引发的炎症反应。实验结果表明,该微载体/生物反应器平台制备的疫苗具有显著免疫保护效果,其综合性能优于传统转瓶培养系统。
选择依据
培养基选择:Vero细胞培养基适合贴壁培养,MDCK培养基更适合悬浮流感病毒生产。
稳定剂差异:海藻糖适合干燥保存,人血白蛋白用于液态疫苗稳定性提升。
灭活剂对比:β-丙内酯优于甲醛的残留安全性,Triton X-100需注意环境毒性。
推荐产品
类别 | 产品 | 适用场景 | |
病毒增殖培养基 | VeroSFM | 无血清无动物源,化学成分限定,GMP标准生产,适合大规模工业化疫苗生产 | |
Vero VM (病毒维持液) | 无血清无动物源,支持Vero细胞贴壁培养,适用于狂犬病、乙脑等疫苗生产 | ||
MDCK SFM | 无血清无动物源悬浮培养基,支持MDCK细胞高密度培养,用于流感疫苗生产 | ||
病毒稳定剂 | ACJ1857A | 药用级海藻糖 | 非还原性稳定剂,保护病毒活性,可常温保存生物制品 |
ACJ0073B | 蔗糖 | 用于病毒纯化密度梯度离心,RNase/DNase Free | |
DCL0119D | 人血白蛋白 | 高浓度白蛋白,作为疫苗稳定剂,防止蛋白变性 | |
病毒灭活试剂 | AJL0175F | β-丙内酯(BPL) | 作用于病毒核酸,灭活时间短,水解产物无毒,适用于狂犬病等疫苗 |
ACH0026Q | Triton X-100 | 非离子去垢剂,破坏脂质膜灭活包膜病毒,适用于生物制品灭活 | |
疫苗佐剂 | AEI0021I | 氢氧化铝佐剂 | 促进体液免疫(抗体)反应和TH2类细胞免疫反应;用于疫苗和兽用疫苗。 |
参考文献
[1]. Jeon BY, et al.Co-immunization of plasmid DNA encoding IL-12 and IL-18 with Bacillus Calmette-Guérin vaccine against progressive tuberculosis.Yonsei medical journal(2011)
[2]. Choi HJ, et al. Effect of AcHERV-GmCSF as an Influenza Virus Vaccine Adjuvant. PloS one(2015)



