摘要:研究发现菊粉(inulin)可通过重塑肠道菌群促进果糖(fructose)在小肠的微生物代谢
在现代饮食结构中,高果糖玉米糖浆(HFCS)的广泛使用已成为代谢性疾病的重要诱因。特别值得关注的是,约20%的代谢功能障碍相关脂肪性肝病(MASLD)患者并不伴随肥胖,这类"瘦型MASLD"患者因缺乏典型症状往往错过最佳干预时机,其进展为肝纤维化、肝硬化和肝癌的风险反而更高。果糖的毒性效应主要源于其独特的代谢途径:通过不受调控的酮己糖激酶(KHK)快速消耗ATP,并产生具有细胞毒性的甘油醛。与此同时,作为果糖聚合物的膳食纤维菊粉却展现出改善代谢的潜力,但传统研究多聚焦于结肠菌群产生的短链脂肪酸(SCFA)机制,未能完全解释其保护作用。
为揭示菊粉缓解果糖毒性的深层机制,Sunhee Jung等研究人员在《Nature Metabolism》发表的研究采用了多组学整合分析策略。通过建立HFCS诱导的瘦型MASLD小鼠模型,结合稳定同位素示踪技术(13C-fructose和2H2O)动态监测果糖代谢流向,采用宏基因组学解析菌群结构变化,并运用转录组学和代谢组学系统评估肝脏代谢重编程。特别设计了延迟干预实验组(CIF),验证菊粉对已形成脂肪肝的逆转效果。

图1 适应膳食纤维的肠道菌群清除膳食果糖并逆转肝脏脂肪变性
研究首先通过长达30周的动物实验证实,无论是同步还是延迟补充菊粉,都能显著改善HFCS诱导的代谢异常。与单纯HFCS组相比,菊粉干预使小鼠脂肪含量降低28%,肝脏甘油三酯(TG)减少40%,胰岛素抵抗指数(HOMA-IR)下降35%。通过13C标记示踪发现,菊粉并不影响宿主小肠的果糖代谢能力,而是使空肠内容物中13C-乙酸盐增加3倍,同时结肠内容物中果糖及其代谢产物减少90%,表明菊粉促进小肠菌群对果糖的"首过代谢"。
机制研究发现,菊粉通过双重途径发挥保护作用:其一,重塑的肠道菌群(特别是Bacteroides acidifaciens)表现出增强的果糖分解能力,减少果糖向肝脏和结肠的溢出,从而抑制肝脏脂肪新生(DNL)相关基因(Accs2、Scd1)表达;其二,激活肝脏丝氨酸合成通路(Phgdh、Psat1上调10-22倍)和胱氨酸转运体Slc7a11(上调53倍),促进谷胱甘肽合成,使肝脏脂质过氧化标志物4-HNE降低60%。通过菌群移植实验证实,菊粉的这些效应具有可传递性,将菊粉适应菌群移植给无菌小鼠,可重现果糖代谢改善和脂质合成抑制的表型。
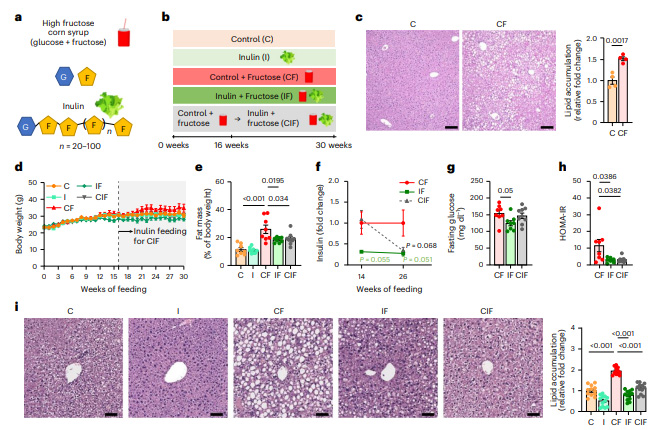
图2 菊粉补充逆转高果糖玉米糖浆诱导的代谢功能障碍
研究最终确立了"膳食纤维-菌群-宿主"三方互作的新范式:菊粉作为果糖聚合物,能够定向富集具有高效果糖分解能力的菌群(如B. acidifaciens),这些"训练有素"的微生物遇到单体果糖时,可迅速启动分解代谢程序,在肠道前端形成"代谢屏障"。该发现不仅解释了为何不同纤维的保护效果存在差异(菊粉与果糖的结构相似性使其具有独特优势),更重要的是提出了"营养素的微生物解毒"新概念——通过合理设计膳食成分,可以编程肠道菌群成为抵御有害营养素的"生物过滤器"。
这项研究为代谢性肝病的干预提供了全新视角:首先,将防治窗口前移至营养素吸收前的肠道微生物代谢环节;其次,发现丝氨酸-GSH轴是菊粉改善氧化应激的关键靶点;最后,鉴定出B. acidifaciens作为潜在益生菌株的应用价值。这些发现对开发针对西方饮食相关代谢紊乱的精准营养策略具有重要指导意义,特别是为瘦型MASLD这一临床难题提供了安全经济的解决方案。未来研究可进一步探索菊粉最佳补充剂量、干预时机以及个体化菌群调控方案,推动研究成果向临床应用转化。
参考资料
[1] Dietary fibre-adapted gut microbiome clears dietary fructose and reverses hepatic steatosis
摘要:研究发现菊粉(inulin)可通过重塑肠道菌群促进果糖(fructose)在小肠的微生物代谢
在现代饮食结构中,高果糖玉米糖浆(HFCS)的广泛使用已成为代谢性疾病的重要诱因。特别值得关注的是,约20%的代谢功能障碍相关脂肪性肝病(MASLD)患者并不伴随肥胖,这类"瘦型MASLD"患者因缺乏典型症状往往错过最佳干预时机,其进展为肝纤维化、肝硬化和肝癌的风险反而更高。果糖的毒性效应主要源于其独特的代谢途径:通过不受调控的酮己糖激酶(KHK)快速消耗ATP,并产生具有细胞毒性的甘油醛。与此同时,作为果糖聚合物的膳食纤维菊粉却展现出改善代谢的潜力,但传统研究多聚焦于结肠菌群产生的短链脂肪酸(SCFA)机制,未能完全解释其保护作用。
为揭示菊粉缓解果糖毒性的深层机制,Sunhee Jung等研究人员在《Nature Metabolism》发表的研究采用了多组学整合分析策略。通过建立HFCS诱导的瘦型MASLD小鼠模型,结合稳定同位素示踪技术(13C-fructose和2H2O)动态监测果糖代谢流向,采用宏基因组学解析菌群结构变化,并运用转录组学和代谢组学系统评估肝脏代谢重编程。特别设计了延迟干预实验组(CIF),验证菊粉对已形成脂肪肝的逆转效果。

图1 适应膳食纤维的肠道菌群清除膳食果糖并逆转肝脏脂肪变性
研究首先通过长达30周的动物实验证实,无论是同步还是延迟补充菊粉,都能显著改善HFCS诱导的代谢异常。与单纯HFCS组相比,菊粉干预使小鼠脂肪含量降低28%,肝脏甘油三酯(TG)减少40%,胰岛素抵抗指数(HOMA-IR)下降35%。通过13C标记示踪发现,菊粉并不影响宿主小肠的果糖代谢能力,而是使空肠内容物中13C-乙酸盐增加3倍,同时结肠内容物中果糖及其代谢产物减少90%,表明菊粉促进小肠菌群对果糖的"首过代谢"。
机制研究发现,菊粉通过双重途径发挥保护作用:其一,重塑的肠道菌群(特别是Bacteroides acidifaciens)表现出增强的果糖分解能力,减少果糖向肝脏和结肠的溢出,从而抑制肝脏脂肪新生(DNL)相关基因(Accs2、Scd1)表达;其二,激活肝脏丝氨酸合成通路(Phgdh、Psat1上调10-22倍)和胱氨酸转运体Slc7a11(上调53倍),促进谷胱甘肽合成,使肝脏脂质过氧化标志物4-HNE降低60%。通过菌群移植实验证实,菊粉的这些效应具有可传递性,将菊粉适应菌群移植给无菌小鼠,可重现果糖代谢改善和脂质合成抑制的表型。

图2 菊粉补充逆转高果糖玉米糖浆诱导的代谢功能障碍
研究最终确立了"膳食纤维-菌群-宿主"三方互作的新范式:菊粉作为果糖聚合物,能够定向富集具有高效果糖分解能力的菌群(如B. acidifaciens),这些"训练有素"的微生物遇到单体果糖时,可迅速启动分解代谢程序,在肠道前端形成"代谢屏障"。该发现不仅解释了为何不同纤维的保护效果存在差异(菊粉与果糖的结构相似性使其具有独特优势),更重要的是提出了"营养素的微生物解毒"新概念——通过合理设计膳食成分,可以编程肠道菌群成为抵御有害营养素的"生物过滤器"。
这项研究为代谢性肝病的干预提供了全新视角:首先,将防治窗口前移至营养素吸收前的肠道微生物代谢环节;其次,发现丝氨酸-GSH轴是菊粉改善氧化应激的关键靶点;最后,鉴定出B. acidifaciens作为潜在益生菌株的应用价值。这些发现对开发针对西方饮食相关代谢紊乱的精准营养策略具有重要指导意义,特别是为瘦型MASLD这一临床难题提供了安全经济的解决方案。未来研究可进一步探索菊粉最佳补充剂量、干预时机以及个体化菌群调控方案,推动研究成果向临床应用转化。
参考资料
[1] Dietary fibre-adapted gut microbiome clears dietary fructose and reverses hepatic steatosis



