摘要:针对HER2低表达(IHC 1+或IHC 2+/ISH-)转移性乳腺癌化疗后治疗困境,研究人员开展III期DESTINY-Breast04试验。
在乳腺癌精准治疗领域,人类表皮生长因子受体2(HER2)表达状态长期主导着治疗决策格局。传统上,HER2阳性(免疫组化[IHC] 3+或IHC 2+/原位杂交[ISH]+)患者可从HER2靶向治疗中获益,而HER2阴性(IHC 0、IHC 1+或IHC 2+/ISH-)患者则缺乏有效的靶向治疗选择。然而,随着检测技术的精进和新型抗体药物偶联物(ADC)的出现,HER2低表达(IHC 1+或IHC 2+/ISH-)这一新分类逐渐受到关注。回顾性研究显示,约65%原属HER2阴性的肿瘤实际上符合HER2低表达标准,这为大量患者提供了新的治疗机会。
激素受体(HR)状态同样是影响乳腺癌预后的关键因素。根据美国临床肿瘤学会/美国病理学家学院(ASCO/CAP)指南,HR阳性定义为≥1%肿瘤细胞核表达雌激素受体(ER)或孕激素受体(PR)。值得注意的是,ER低阳性(1%-10%染色)患者对内分泌治疗反应不佳,其临床特征更接近HR阴性肿瘤,这增加了治疗选择的复杂性。

图1 德曲妥珠单抗在HER2低表达转移性乳腺癌中的应用:随机三期DESTINY-Breast04试验的长期生存分析
DESTINY-Breast04试验应运而生,旨在解决HER2低表达转移性乳腺癌患者化疗后的治疗难题。这项开放标签、随机、III期临床研究比较了Trastuzumab deruxtecan(T-DXd)与医生选择的化疗(TPC)在既往接受过1-2线化疗的HER2低表达转移性乳腺癌患者中的疗效和安全性。T-DXd是一种由人源化抗HER2单克隆抗体与拓扑异构酶I抑制剂通过可裂解连接子组成的ADC,具有独特的"旁观者效应",可杀伤邻近肿瘤细胞。
主要技术方法包括:采用中心实验室验证的VENTANA HER2/neu(4B5)检测进行免疫组化分析,ISH检测使用INFORM HER2 Dual ISH DNA Probe Cocktail assay;通过盲态独立中心审查(BICR)和研究者评估评估疗效终点;安全性评估遵循MedDRA和CTCAE标准;独立裁定委员会对间质性肺病/肺炎病例进行专门评估。研究纳入577例经中心实验室确认的HER2低表达转移性乳腺癌患者。
疗效结果
在延长至32.0个月的中位随访后,T-DXd显示出持续的生存优势。总体人群中,T-DXd组中位总生存期(OS)为22.9个月,显著优于TPC组的16.8个月(风险比[HR] 0.69)。HR阳性队列中,T-DXd组中位OS为23.9个月,TPC组为17.6个月(HR 0.69)。甚至在探索性分析的HR阴性队列中,T-DXd组中位OS达17.1个月,而TPC组仅8.3个月(HR 0.58),24个月OS率更是TPC组的近三倍(32.6% vs 11.8%)。
无进展生存期方面,研究者评估的总体人群中位PFS在T-DXd组为8.8个月,TPC组为4.2个月(HR 0.36)。HR阳性队列中,T-DXd组中位PFS为9.6个月,TPC组为4.2个月(HR 0.37)。HR阴性队列同样显示T-DXd优势(6.3 vs 2.9个月;HR 0.29)。
探索性分析揭示了不同ER表达水平患者的获益情况。在ER>10%亚组中,T-DXd组中位OS为24.0个月,TPC组为18.9个月(HR 0.72);ER低阳性(1%-10%)亚组中,T-DXd组中位OS达22.3个月,而TPC组仅10.2个月(HR 0.40),表明T-DXd疗效不受ER表达水平影响。
安全性特征
T-DXd安全性特征与初步分析一致,未出现新的安全性信号。中位治疗持续时间T-DXd组为8.2个月,TPC组为3.5个月。经暴露校正后,T-DXd组任何级别治疗相关不良事件(TEAEs)发生率为1.16/患者年,低于TPC组的2.64/患者年。
T-DXd组最常见任何级别药物相关TEAEs包括恶心(76.0%)、疲劳(55.0%)、呕吐(40.7%)和脱发(39.9%)。≥3级药物相关TEAEs主要为中性粒细胞减少(14.6%)、贫血(10.8%)和疲劳(9.7%)。
特别关注的不良事件中,经裁定的药物相关间质性肺病(ILD)/肺炎发生率为12.1%,多数为低级事件(1-2级占10%),≥3级事件占2.2%。左心室功能障碍发生率为5.1%,主要为射血分数下降(4.9%),无4级事件。
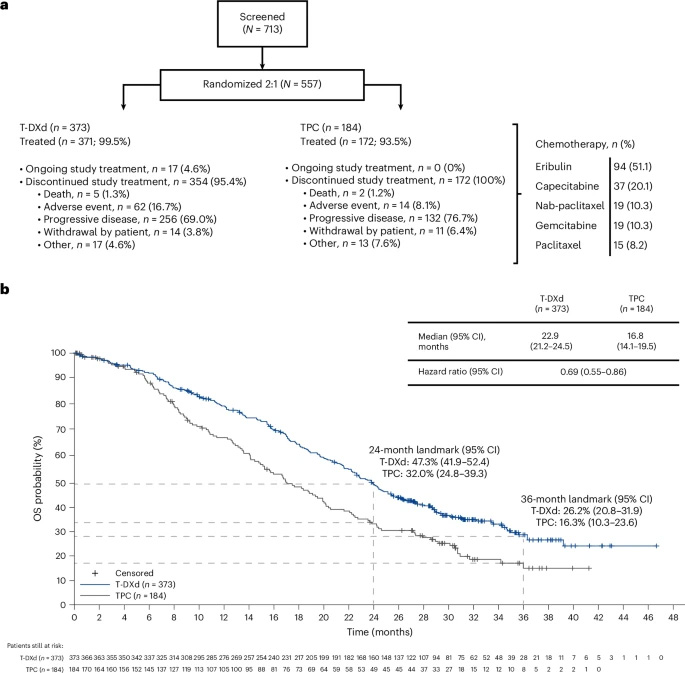
图2 患者分组情况及总人群总生存期的Kaplan–Meier分析曲线
研究结论与意义
DESTINY-Breast04的最终分析证实了T-DXd在HER2低表达转移性乳腺癌中的持久临床获益。无论HR状态如何,T-DXd相比化疗显著改善生存结局,且安全性可控。该研究不仅确立了T-DXd作为HER2低表达乳腺癌化疗后标准治疗的地位,更重新定义了乳腺癌分子分型格局。
值得注意的是,HER2低表达和最新提出的HER2超低表达(IHC 0伴微弱染色)的识别仍是临床挑战。随着DESTINY-Breast06试验证实T-DXd在HER2超低表达患者中的疗效,优化检测方法和统一病理判读标准显得尤为重要。这项发表在《Nature Medicine》的研究标志着乳腺癌靶向治疗进入新纪元,为传统认为"不可靶向"的患者群体带来了希望,推动了精准医疗理念的深化和实践的拓展。
研究的局限性包括开放标签设计可能引入偏倚,且探索性分析样本量有限。未来研究应聚焦生物标志物开发、耐药机制探索以及T-DXd在更早线治疗中的应用,进一步优化HER2低表达乳腺癌的治疗策略。
参考资料
[1] Trastuzumab deruxtecan in HER2-low metastatic breast cancer: long-term survival analysis of the randomized, phase 3 DESTINY-Breast04 trial
摘要:针对HER2低表达(IHC 1+或IHC 2+/ISH-)转移性乳腺癌化疗后治疗困境,研究人员开展III期DESTINY-Breast04试验。
在乳腺癌精准治疗领域,人类表皮生长因子受体2(HER2)表达状态长期主导着治疗决策格局。传统上,HER2阳性(免疫组化[IHC] 3+或IHC 2+/原位杂交[ISH]+)患者可从HER2靶向治疗中获益,而HER2阴性(IHC 0、IHC 1+或IHC 2+/ISH-)患者则缺乏有效的靶向治疗选择。然而,随着检测技术的精进和新型抗体药物偶联物(ADC)的出现,HER2低表达(IHC 1+或IHC 2+/ISH-)这一新分类逐渐受到关注。回顾性研究显示,约65%原属HER2阴性的肿瘤实际上符合HER2低表达标准,这为大量患者提供了新的治疗机会。
激素受体(HR)状态同样是影响乳腺癌预后的关键因素。根据美国临床肿瘤学会/美国病理学家学院(ASCO/CAP)指南,HR阳性定义为≥1%肿瘤细胞核表达雌激素受体(ER)或孕激素受体(PR)。值得注意的是,ER低阳性(1%-10%染色)患者对内分泌治疗反应不佳,其临床特征更接近HR阴性肿瘤,这增加了治疗选择的复杂性。

图1 德曲妥珠单抗在HER2低表达转移性乳腺癌中的应用:随机三期DESTINY-Breast04试验的长期生存分析
DESTINY-Breast04试验应运而生,旨在解决HER2低表达转移性乳腺癌患者化疗后的治疗难题。这项开放标签、随机、III期临床研究比较了Trastuzumab deruxtecan(T-DXd)与医生选择的化疗(TPC)在既往接受过1-2线化疗的HER2低表达转移性乳腺癌患者中的疗效和安全性。T-DXd是一种由人源化抗HER2单克隆抗体与拓扑异构酶I抑制剂通过可裂解连接子组成的ADC,具有独特的"旁观者效应",可杀伤邻近肿瘤细胞。
主要技术方法包括:采用中心实验室验证的VENTANA HER2/neu(4B5)检测进行免疫组化分析,ISH检测使用INFORM HER2 Dual ISH DNA Probe Cocktail assay;通过盲态独立中心审查(BICR)和研究者评估评估疗效终点;安全性评估遵循MedDRA和CTCAE标准;独立裁定委员会对间质性肺病/肺炎病例进行专门评估。研究纳入577例经中心实验室确认的HER2低表达转移性乳腺癌患者。
疗效结果
在延长至32.0个月的中位随访后,T-DXd显示出持续的生存优势。总体人群中,T-DXd组中位总生存期(OS)为22.9个月,显著优于TPC组的16.8个月(风险比[HR] 0.69)。HR阳性队列中,T-DXd组中位OS为23.9个月,TPC组为17.6个月(HR 0.69)。甚至在探索性分析的HR阴性队列中,T-DXd组中位OS达17.1个月,而TPC组仅8.3个月(HR 0.58),24个月OS率更是TPC组的近三倍(32.6% vs 11.8%)。
无进展生存期方面,研究者评估的总体人群中位PFS在T-DXd组为8.8个月,TPC组为4.2个月(HR 0.36)。HR阳性队列中,T-DXd组中位PFS为9.6个月,TPC组为4.2个月(HR 0.37)。HR阴性队列同样显示T-DXd优势(6.3 vs 2.9个月;HR 0.29)。
探索性分析揭示了不同ER表达水平患者的获益情况。在ER>10%亚组中,T-DXd组中位OS为24.0个月,TPC组为18.9个月(HR 0.72);ER低阳性(1%-10%)亚组中,T-DXd组中位OS达22.3个月,而TPC组仅10.2个月(HR 0.40),表明T-DXd疗效不受ER表达水平影响。
安全性特征
T-DXd安全性特征与初步分析一致,未出现新的安全性信号。中位治疗持续时间T-DXd组为8.2个月,TPC组为3.5个月。经暴露校正后,T-DXd组任何级别治疗相关不良事件(TEAEs)发生率为1.16/患者年,低于TPC组的2.64/患者年。
T-DXd组最常见任何级别药物相关TEAEs包括恶心(76.0%)、疲劳(55.0%)、呕吐(40.7%)和脱发(39.9%)。≥3级药物相关TEAEs主要为中性粒细胞减少(14.6%)、贫血(10.8%)和疲劳(9.7%)。
特别关注的不良事件中,经裁定的药物相关间质性肺病(ILD)/肺炎发生率为12.1%,多数为低级事件(1-2级占10%),≥3级事件占2.2%。左心室功能障碍发生率为5.1%,主要为射血分数下降(4.9%),无4级事件。

图2 患者分组情况及总人群总生存期的Kaplan–Meier分析曲线
研究结论与意义
DESTINY-Breast04的最终分析证实了T-DXd在HER2低表达转移性乳腺癌中的持久临床获益。无论HR状态如何,T-DXd相比化疗显著改善生存结局,且安全性可控。该研究不仅确立了T-DXd作为HER2低表达乳腺癌化疗后标准治疗的地位,更重新定义了乳腺癌分子分型格局。
值得注意的是,HER2低表达和最新提出的HER2超低表达(IHC 0伴微弱染色)的识别仍是临床挑战。随着DESTINY-Breast06试验证实T-DXd在HER2超低表达患者中的疗效,优化检测方法和统一病理判读标准显得尤为重要。这项发表在《Nature Medicine》的研究标志着乳腺癌靶向治疗进入新纪元,为传统认为"不可靶向"的患者群体带来了希望,推动了精准医疗理念的深化和实践的拓展。
研究的局限性包括开放标签设计可能引入偏倚,且探索性分析样本量有限。未来研究应聚焦生物标志物开发、耐药机制探索以及T-DXd在更早线治疗中的应用,进一步优化HER2低表达乳腺癌的治疗策略。
参考资料
[1] Trastuzumab deruxtecan in HER2-low metastatic breast cancer: long-term survival analysis of the randomized, phase 3 DESTINY-Breast04 trial



