摘要:本研究揭示了组蛋白H3K9乳酸化(H3K9la)通过转录调控NFATc2表达促进纤维样滑膜细胞(FLSs)迁移侵袭的新机制。
类风湿关节炎(Rheumatoid Arthritis, RA)是一种以慢性滑膜炎、自身抗体产生和关节骨破坏为特征的自身免疫性疾病。在RA患者的关节微环境中,缺氧和代谢重编程导致乳酸大量积累,形成高乳酸微环境。虽然既往研究提示乳酸可能参与RA进展,但其具体分子机制始终不明。近年来,乳酸被发现在肿瘤免疫等领域作为信号分子发挥重要调控作用,特别是组蛋白乳酸化作为一种新型蛋白质翻译后修饰,在多种疾病中被证实具有基因转录调控功能。然而,组蛋白乳酸化是否在RA发病过程中发挥作用,以及是否参与自身抗体的产生,仍有待深入探索。
温州医科大学研究团队在《Nature Communications》发表的最新研究,首次系统揭示了组蛋白乳酸化修饰在RA疾病进展中的关键作用。研究人员通过整合多组学分析、分子生物学实验和动物模型验证,阐明了乳酸依赖性组蛋白修饰调控纤维样滑膜细胞(Fibroblast-like Synoviocytes, FLSs)致病性的新机制,并为RA诊断提供了新型血清学标志物。

图1 组蛋白乳酸化通过增加NFATc2表达及抗乳酸化组蛋白自身抗体产生促进类风湿关节炎进展
研究采用的主要技术方法包括:Western blot和免疫荧光检测组蛋白乳酸化水平;CUT & Tag技术(切割标签技术)联合RNA测序筛选H3K9la靶基因;染色质免疫沉淀(ChIP-qPCR)验证组蛋白修饰与基因启动子结合;利用胶原诱导性关节炎(CIA)和胶原抗体诱导性关节炎(CAIA)小鼠模型进行体内功能验证;ELISA检测血清自身抗体水平。所有人类样本均来源于未经疾病修饰抗风湿药(DMARDs)治疗的新诊断RA患者。
研究结果
组蛋白H3K9乳酸化在RA患者滑膜组织中显著升高
研究人员首先发现RA患者FLSs中全局乳酸化水平显著高于健康对照(HC)和痛风性关节炎(GA)患者,且乳酸化蛋白富集于分子量15kDa的核内蛋白。通过pH对照实验排除酸性环境干扰,证实乳酸钠和乳酸处理均可特异性增强FLSs的乳酸化修饰。进一步针对8个已知组蛋白乳酸化位点的检测显示,H3K9la在RA患者FLSs和滑膜组织中表达显著上调,且乳酸处理可明显促进H3K9la水平。
NFATc2被筛选确认为H3K9la的关键靶基因
通过CUT & Tag技术分析发现,H3K9la在RA-FLSs中更多富集于基因启动子区域,且结合基序与HC存在差异(RA中为"GKACTGTA",HC中为"SKGTATAC")。KEGG通路分析显示H3K9la结合基因显著富集于"类风湿关节炎"通路。整合RNA-seq数据筛选出68个同时存在H3K9la高结合且表达上调的靶基因,其中7个基因与"细胞运动性"功能相关。进一步筛选发现NFATc2和IL12A启动子区域存在H3K9la结合基序,且NFATc2表达差异最显著。ChIP-qPCR证实H3K9la在NFATc2启动子区域高度富集,RT-qPCR验证NFATc2在RA-FLSs中表达上调。
NFATc2过表达通过增强FLS迁移侵袭促进RA进展
实验证实NFATc2在RA患者FLSs和滑膜组织中表达升高,且去磷酸化活化和核转位增强。通过shRNA敲低NFATc2表达后,RA-FLSs的迁移侵袭能力显著减弱。在SCID小鼠共植入模型中,敲低NFATc2的RA-FLSs软骨侵蚀能力降低。在CIA小鼠模型中,关节内注射LV-shNFATc2慢病毒可减轻关节肿胀和组织病理评分。FLS特异性NFATc2敲除小鼠在CAIA模型中关节炎症状明显改善。RNA-seq分析显示,敲低NFATc2后MMP9、MMP13和IL-6等软骨破坏和炎症相关基因表达下调。
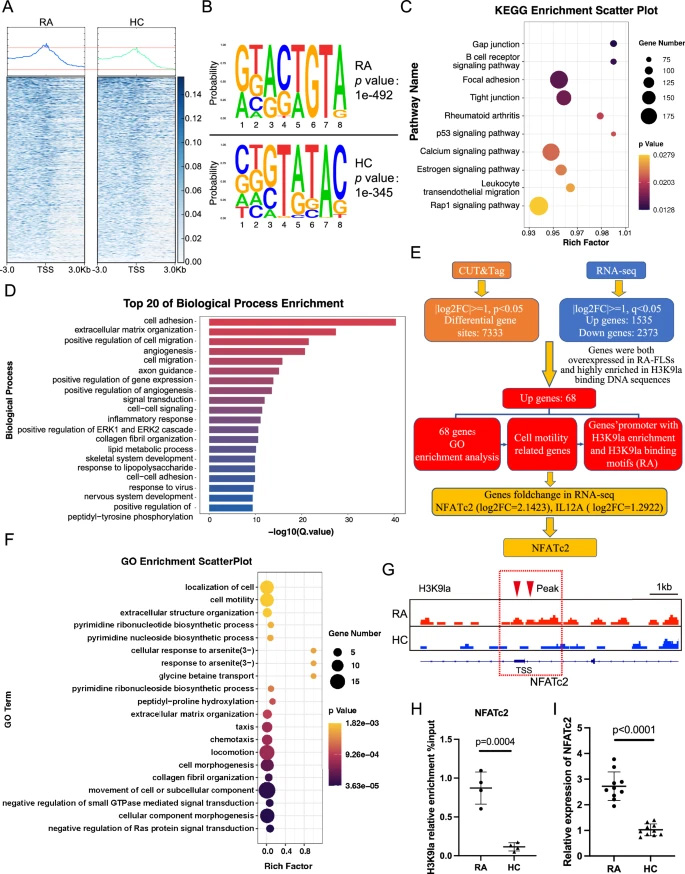
图2 运用CUT & Tag与RNA-seq技术筛选H3K9乳酸化修饰在类风湿关节炎成纤维样滑膜细胞中调控的靶基因
乳酸依赖性H3K9la增强NFATc2表达
通过干扰乳酸脱氢酶(LDH)表达或活性(使用抑制剂FX-11),细胞内乳酸产生减少导致H3K9la水平下降,NFATc2表达降低,RA-FLSs迁移侵袭能力减弱。另一方面,细胞外乳酸通过单羧酸转运蛋白1(MCT1)进入细胞,乳酸干预可增加H3K9la水平和NFATc2表达,促进FLS迁移和细胞因子分泌,而MCT1抑制剂AZD-3965可阻断这些效应。
靶向H3K9la减轻CIA小鼠关节炎进展
在CIA小鼠模型中,FX-11或AZD-3965处理组关节肿胀程度较轻,关节炎评分较低,软骨破坏改善,组织学评分降低。免疫荧光显示FX-11或AZD-3965治疗降低了滑膜组织中H3K9la水平和NFATc2表达。同时,治疗组血清中促炎细胞因子(TNF-α、IL-6、IL-1β)浓度降低,抗炎细胞因子IL-10浓度升高。与甲氨蝶呤(MTX)联合治疗后,关节炎症状进一步改善。
RA患者血清中存在特异性识别乳酸化组蛋白的自身抗体
研究发现RA患者血清中存在抗乳酸化组蛋白自身抗体,包括抗H2B、H3和H4乳酸化抗体。ELISA检测显示RA患者抗乳酸化组蛋白自身抗体水平显著高于HC和银屑病关节炎(PsA)患者,其中抗H3K9la抗体与DAS28评分呈正相关,且在高活动度RA患者中水平更高。抗H3K9la抗体在血清阳性和血清阴性RA患者中均存在,与抗CCP抗体水平无相关性。
研究结论与意义
本研究首次系统揭示了组蛋白乳酸化修饰在RA发病机制中的关键作用:RA关节高乳酸微环境通过促进组蛋白H3K9乳酸化修饰,转录上调NFATc2表达,增强FLSs的迁移侵袭能力,从而推动关节炎进展。同时发现的抗乳酸化组蛋白自身抗体为RA诊断提供了新的血清学标志物。
该研究的重要意义在于:从表观遗传学角度揭示了乳酸代谢物在RA中的新型调控机制;鉴定NFATc2作为H3K9la的下游关键效应分子,为RA治疗提供了潜在靶点;发现抗乳酸化组蛋白自身抗体与疾病活动度的相关性,为RA诊断和病情评估提供了新指标;通过抑制乳酸产生(FX-11)和摄取(AZD-3965)可减轻关节炎症状,为RA治疗提供了新的策略思路。
这项研究不仅深化了对RA发病机制的理解,也为开发针对代谢-表观遗传轴的新型治疗方法和诊断工具奠定了重要基础,具有显著的临床转化潜力。
参考资料
[1] Histone lactylation promotes rheumatoid arthritis progression by increasing NFATc2 expression and the production of anti-lactylated histone autoantibodies
摘要:本研究揭示了组蛋白H3K9乳酸化(H3K9la)通过转录调控NFATc2表达促进纤维样滑膜细胞(FLSs)迁移侵袭的新机制。
类风湿关节炎(Rheumatoid Arthritis, RA)是一种以慢性滑膜炎、自身抗体产生和关节骨破坏为特征的自身免疫性疾病。在RA患者的关节微环境中,缺氧和代谢重编程导致乳酸大量积累,形成高乳酸微环境。虽然既往研究提示乳酸可能参与RA进展,但其具体分子机制始终不明。近年来,乳酸被发现在肿瘤免疫等领域作为信号分子发挥重要调控作用,特别是组蛋白乳酸化作为一种新型蛋白质翻译后修饰,在多种疾病中被证实具有基因转录调控功能。然而,组蛋白乳酸化是否在RA发病过程中发挥作用,以及是否参与自身抗体的产生,仍有待深入探索。
温州医科大学研究团队在《Nature Communications》发表的最新研究,首次系统揭示了组蛋白乳酸化修饰在RA疾病进展中的关键作用。研究人员通过整合多组学分析、分子生物学实验和动物模型验证,阐明了乳酸依赖性组蛋白修饰调控纤维样滑膜细胞(Fibroblast-like Synoviocytes, FLSs)致病性的新机制,并为RA诊断提供了新型血清学标志物。

图1 组蛋白乳酸化通过增加NFATc2表达及抗乳酸化组蛋白自身抗体产生促进类风湿关节炎进展
研究采用的主要技术方法包括:Western blot和免疫荧光检测组蛋白乳酸化水平;CUT&Tag技术(切割标签技术)联合RNA测序筛选H3K9la靶基因;染色质免疫沉淀(ChIP-qPCR)验证组蛋白修饰与基因启动子结合;利用胶原诱导性关节炎(CIA)和胶原抗体诱导性关节炎(CAIA)小鼠模型进行体内功能验证;ELISA检测血清自身抗体水平。所有人类样本均来源于未经疾病修饰抗风湿药(DMARDs)治疗的新诊断RA患者。
研究结果
组蛋白H3K9乳酸化在RA患者滑膜组织中显著升高
研究人员首先发现RA患者FLSs中全局乳酸化水平显著高于健康对照(HC)和痛风性关节炎(GA)患者,且乳酸化蛋白富集于分子量15kDa的核内蛋白。通过pH对照实验排除酸性环境干扰,证实乳酸钠和乳酸处理均可特异性增强FLSs的乳酸化修饰。进一步针对8个已知组蛋白乳酸化位点的检测显示,H3K9la在RA患者FLSs和滑膜组织中表达显著上调,且乳酸处理可明显促进H3K9la水平。
NFATc2被筛选确认为H3K9la的关键靶基因
通过CUT&Tag技术分析发现,H3K9la在RA-FLSs中更多富集于基因启动子区域,且结合基序与HC存在差异(RA中为"GKACTGTA",HC中为"SKGTATAC")。KEGG通路分析显示H3K9la结合基因显著富集于"类风湿关节炎"通路。整合RNA-seq数据筛选出68个同时存在H3K9la高结合且表达上调的靶基因,其中7个基因与"细胞运动性"功能相关。进一步筛选发现NFATc2和IL12A启动子区域存在H3K9la结合基序,且NFATc2表达差异最显著。ChIP-qPCR证实H3K9la在NFATc2启动子区域高度富集,RT-qPCR验证NFATc2在RA-FLSs中表达上调。
NFATc2过表达通过增强FLS迁移侵袭促进RA进展
实验证实NFATc2在RA患者FLSs和滑膜组织中表达升高,且去磷酸化活化和核转位增强。通过shRNA敲低NFATc2表达后,RA-FLSs的迁移侵袭能力显著减弱。在SCID小鼠共植入模型中,敲低NFATc2的RA-FLSs软骨侵蚀能力降低。在CIA小鼠模型中,关节内注射LV-shNFATc2慢病毒可减轻关节肿胀和组织病理评分。FLS特异性NFATc2敲除小鼠在CAIA模型中关节炎症状明显改善。RNA-seq分析显示,敲低NFATc2后MMP9、MMP13和IL-6等软骨破坏和炎症相关基因表达下调。

图2 运用CUT & Tag与RNA-seq技术筛选H3K9乳酸化修饰在类风湿关节炎成纤维样滑膜细胞中调控的靶基因
乳酸依赖性H3K9la增强NFATc2表达
通过干扰乳酸脱氢酶(LDH)表达或活性(使用抑制剂FX-11),细胞内乳酸产生减少导致H3K9la水平下降,NFATc2表达降低,RA-FLSs迁移侵袭能力减弱。另一方面,细胞外乳酸通过单羧酸转运蛋白1(MCT1)进入细胞,乳酸干预可增加H3K9la水平和NFATc2表达,促进FLS迁移和细胞因子分泌,而MCT1抑制剂AZD-3965可阻断这些效应。
靶向H3K9la减轻CIA小鼠关节炎进展
在CIA小鼠模型中,FX-11或AZD-3965处理组关节肿胀程度较轻,关节炎评分较低,软骨破坏改善,组织学评分降低。免疫荧光显示FX-11或AZD-3965治疗降低了滑膜组织中H3K9la水平和NFATc2表达。同时,治疗组血清中促炎细胞因子(TNF-α、IL-6、IL-1β)浓度降低,抗炎细胞因子IL-10浓度升高。与甲氨蝶呤(MTX)联合治疗后,关节炎症状进一步改善。
RA患者血清中存在特异性识别乳酸化组蛋白的自身抗体
研究发现RA患者血清中存在抗乳酸化组蛋白自身抗体,包括抗H2B、H3和H4乳酸化抗体。ELISA检测显示RA患者抗乳酸化组蛋白自身抗体水平显著高于HC和银屑病关节炎(PsA)患者,其中抗H3K9la抗体与DAS28评分呈正相关,且在高活动度RA患者中水平更高。抗H3K9la抗体在血清阳性和血清阴性RA患者中均存在,与抗CCP抗体水平无相关性。
研究结论与意义
本研究首次系统揭示了组蛋白乳酸化修饰在RA发病机制中的关键作用:RA关节高乳酸微环境通过促进组蛋白H3K9乳酸化修饰,转录上调NFATc2表达,增强FLSs的迁移侵袭能力,从而推动关节炎进展。同时发现的抗乳酸化组蛋白自身抗体为RA诊断提供了新的血清学标志物。
该研究的重要意义在于:从表观遗传学角度揭示了乳酸代谢物在RA中的新型调控机制;鉴定NFATc2作为H3K9la的下游关键效应分子,为RA治疗提供了潜在靶点;发现抗乳酸化组蛋白自身抗体与疾病活动度的相关性,为RA诊断和病情评估提供了新指标;通过抑制乳酸产生(FX-11)和摄取(AZD-3965)可减轻关节炎症状,为RA治疗提供了新的策略思路。
这项研究不仅深化了对RA发病机制的理解,也为开发针对代谢-表观遗传轴的新型治疗方法和诊断工具奠定了重要基础,具有显著的临床转化潜力。
参考资料
[1] Histone lactylation promotes rheumatoid arthritis progression by increasing NFATc2 expression and the production of anti-lactylated histone autoantibodies



