摘要:本研究突破传统单因素病因框架,提出帕金森病(PD)的多维度发病机制。
当谈及帕金森病,人们往往会想到震颤、行动迟缓等运动症状,但隐藏在这些表象之下的病因之谜却一直困扰着科学界。这种神经退行性疾病已成为全球增长最快的神经系统疾病,预计到2040年患者人数将达到1750万。传统上,医学界将帕金森病划分为家族性和散发性两种类型,然而这种非黑即白的分类方式正面临挑战——仅有10-15%的病例有明确家族史,而绝大多数患者的发病原因仍然成谜。
更令人困惑的是,即使携带已知的致病基因突变,如SNCA或LRRK2基因变异,也并非所有人都会发病。这种不完全外显现象提示我们,遗传因素 alone 并不足以引发疾病。那么,是什么决定了携带易感基因的个体最终是否会发展为帕金森病患者?近年来,科学家们逐渐将目光投向基因与环境之间复杂的相互作用,而最新研究发现,一组名为细胞色素P450的酶系可能在这一过程中扮演着关键角色。

图1 帕金森病病因学的多维视角
在这篇发表于《npj Parkinson's Disease》的视角文章中,研究人员提出了一个全新的多维框架来理解帕金森病的病因。他们通过系统分析帕金森病标志物计划(PPMI)数据库中的基因组数据,发现细胞色素P450酶系与帕金森病发病风险存在显著关联。这些酶不仅参与外源性毒素的代谢,还调控着体内胆固醇降解、维生素代谢以及类二十烷酸等重要生理过程,恰如连接遗传易感性与环境因素的重要桥梁。
研究人员采用全基因组关联分析(GWAS)方法,系统筛查了57种人类P450酶及其三个氧化还原伴侣基因中的单核苷酸多态性(SNP)。结果显示,与健康对照组相比,PD患者在26种P450酶基因中存在显著的变异富集现象( odds ratios 显示5-10倍的富集度),这些变异主要分布在基因的调控区域。特别值得注意的是,参与毒素降解的P450亚型(如CYP2D6)在PD患者中表现出明显的变异模式,这与环境毒素在PD病因中的作用高度一致。
研究还发现,P450基因变异可能成为决定遗传易感个体是否发病的“第二击”。对携带已知PD基因突变(如LRRK2或GBA1)的个体进行分析时发现,从无症状状态发展为临床患者(GUN→GPD)的过程中,往往伴随着P450基因的额外变异。三种代谢通路被证实尤为关键:维生素A和D代谢、胆固醇降解以及脂肪酸/类二十烷酸代谢。例如,参与雌激素和维生素A代谢的CYP1B1新近被证实与PD相关,而脑胆固醇降解关键酶CYP46A1的变异则可能成为治疗干预的靶点。
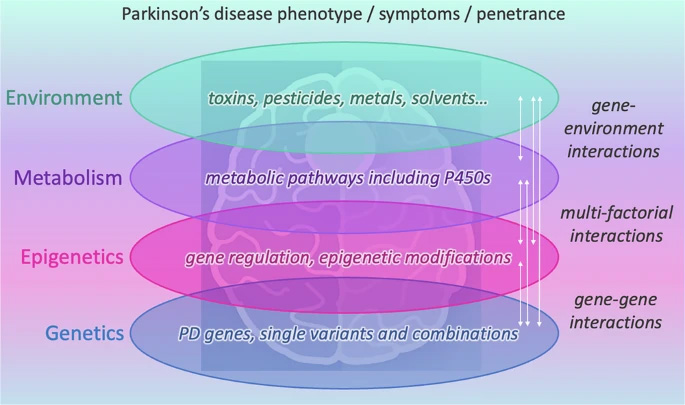
图2 帕金森病的表型/症状/外显率
研究的关键技术方法包括基于PPMI数据库的大规模基因组数据分析、全基因组关联研究(GWAS)筛选P450酶系单核苷酸多态性(SNP)、病例-对照研究设计比较PD患者与健康人群的基因变异频率,以及利用 odds ratios 计算评估变异富集程度。
Cytochrome P450 enzymes as emerging contributors to the etiology of PD
研究发现P450酶系通过多重机制参与PD发病:首先,它们负责降解环境毒素(如农药),基因变异可能导致解毒功能受损;其次,它们调控脑内胆固醇稳态和维生素代谢,这些过程的紊乱与神经炎症和神经元死亡密切相关。特别值得注意的是,某些P450基因的变异频率与已知PD风险基因GBA1处于同一数量级,提示其临床重要性。
What are the consequences of these observations?
这一多维视角完美契合Braak的肠脑轴假说和双重打击假说,将炎症反应、遗传易感性、环境毒素暴露和衰老过程整合统一。研究表明单一因素很少足以引发PD,而是需要多个打击的共同作用,这解释了疾病表现的异质性和治疗反应的差异性。
Novel and future possibilities to causatively treat PD
基于P450酶系在PD中的新角色,研究人员提出个性化治疗新策略:针对特定代谢通路缺陷进行干预,如维生素D代谢异常者补充维生素D或抑制其降解;利用已知P450抑制剂(如他汀类药物)调整胆固醇代谢;对毒素暴露高风险人群进行基因筛查和预防性保护。全基因组测序与人工智能结合将成为发现个体化治疗靶点的关键工具。
这项研究的重大意义在于突破了传统单因素病因观的局限,建立了帕金森病发病机制的多维整合模型。细胞色素P450酶系的发现为理解基因-环境交互作用提供了分子桥梁,为开发真正意义上的个性化治疗奠定了理论基础。未来,基于患者特异的基因变异组合、环境暴露史和代谢特征,医生可能制定出更加精准的防治策略,最终延缓甚至阻止这一重大脑疾病的进展。
参考资料
[1] A multi-dimensional view on the etiology of Parkinson’s disease
摘要:本研究突破传统单因素病因框架,提出帕金森病(PD)的多维度发病机制。
当谈及帕金森病,人们往往会想到震颤、行动迟缓等运动症状,但隐藏在这些表象之下的病因之谜却一直困扰着科学界。这种神经退行性疾病已成为全球增长最快的神经系统疾病,预计到2040年患者人数将达到1750万。传统上,医学界将帕金森病划分为家族性和散发性两种类型,然而这种非黑即白的分类方式正面临挑战——仅有10-15%的病例有明确家族史,而绝大多数患者的发病原因仍然成谜。
更令人困惑的是,即使携带已知的致病基因突变,如SNCA或LRRK2基因变异,也并非所有人都会发病。这种不完全外显现象提示我们,遗传因素 alone 并不足以引发疾病。那么,是什么决定了携带易感基因的个体最终是否会发展为帕金森病患者?近年来,科学家们逐渐将目光投向基因与环境之间复杂的相互作用,而最新研究发现,一组名为细胞色素P450的酶系可能在这一过程中扮演着关键角色。

图1 帕金森病病因学的多维视角
在这篇发表于《npj Parkinson's Disease》的视角文章中,研究人员提出了一个全新的多维框架来理解帕金森病的病因。他们通过系统分析帕金森病标志物计划(PPMI)数据库中的基因组数据,发现细胞色素P450酶系与帕金森病发病风险存在显著关联。这些酶不仅参与外源性毒素的代谢,还调控着体内胆固醇降解、维生素代谢以及类二十烷酸等重要生理过程,恰如连接遗传易感性与环境因素的重要桥梁。
研究人员采用全基因组关联分析(GWAS)方法,系统筛查了57种人类P450酶及其三个氧化还原伴侣基因中的单核苷酸多态性(SNP)。结果显示,与健康对照组相比,PD患者在26种P450酶基因中存在显著的变异富集现象( odds ratios 显示5-10倍的富集度),这些变异主要分布在基因的调控区域。特别值得注意的是,参与毒素降解的P450亚型(如CYP2D6)在PD患者中表现出明显的变异模式,这与环境毒素在PD病因中的作用高度一致。
研究还发现,P450基因变异可能成为决定遗传易感个体是否发病的“第二击”。对携带已知PD基因突变(如LRRK2或GBA1)的个体进行分析时发现,从无症状状态发展为临床患者(GUN→GPD)的过程中,往往伴随着P450基因的额外变异。三种代谢通路被证实尤为关键:维生素A和D代谢、胆固醇降解以及脂肪酸/类二十烷酸代谢。例如,参与雌激素和维生素A代谢的CYP1B1新近被证实与PD相关,而脑胆固醇降解关键酶CYP46A1的变异则可能成为治疗干预的靶点。

图2 帕金森病的表型/症状/外显率
研究的关键技术方法包括基于PPMI数据库的大规模基因组数据分析、全基因组关联研究(GWAS)筛选P450酶系单核苷酸多态性(SNP)、病例-对照研究设计比较PD患者与健康人群的基因变异频率,以及利用 odds ratios 计算评估变异富集程度。
Cytochrome P450 enzymes as emerging contributors to the etiology of PD
研究发现P450酶系通过多重机制参与PD发病:首先,它们负责降解环境毒素(如农药),基因变异可能导致解毒功能受损;其次,它们调控脑内胆固醇稳态和维生素代谢,这些过程的紊乱与神经炎症和神经元死亡密切相关。特别值得注意的是,某些P450基因的变异频率与已知PD风险基因GBA1处于同一数量级,提示其临床重要性。
What are the consequences of these observations?
这一多维视角完美契合Braak的肠脑轴假说和双重打击假说,将炎症反应、遗传易感性、环境毒素暴露和衰老过程整合统一。研究表明单一因素很少足以引发PD,而是需要多个打击的共同作用,这解释了疾病表现的异质性和治疗反应的差异性。
Novel and future possibilities to causatively treat PD
基于P450酶系在PD中的新角色,研究人员提出个性化治疗新策略:针对特定代谢通路缺陷进行干预,如维生素D代谢异常者补充维生素D或抑制其降解;利用已知P450抑制剂(如他汀类药物)调整胆固醇代谢;对毒素暴露高风险人群进行基因筛查和预防性保护。全基因组测序与人工智能结合将成为发现个体化治疗靶点的关键工具。
这项研究的重大意义在于突破了传统单因素病因观的局限,建立了帕金森病发病机制的多维整合模型。细胞色素P450酶系的发现为理解基因-环境交互作用提供了分子桥梁,为开发真正意义上的个性化治疗奠定了理论基础。未来,基于患者特异的基因变异组合、环境暴露史和代谢特征,医生可能制定出更加精准的防治策略,最终延缓甚至阻止这一重大脑疾病的进展。
参考资料
[1] A multi-dimensional view on the etiology of Parkinson’s disease



