在蛋白质组学、生物制药开发及翻译后修饰分析等前沿生物研究领域中,高特异性、高纯度的工具酶发挥着不可或缺的关键作用。随着重组DNA技术的不断进步,重组工具酶凭借其显著性能优势,正逐步取代传统动物源酶,成为科研探索与工业生产的核心试剂。
西宝生物布局高纯度重组工具酶赛道,依托在重组蛋白技术领域的深厚积累,重点开发一系列高特异性、测序级别的重组工具酶产品。以卓越的批次间稳定性和可扩展性,满足从基础科研到大规模工业化生产对关键试剂日益增长的需求,彰显了公司赋能生物医药产业链的决心与实力。
一、蛋白酶类:蛋白质酶解的核心工具
蛋白酶类的核心功能是将完整蛋白质切割为适合分析的肽段,其切割特异性直接决定了酶解效果与后续分析的准确性。
(一)测序级重组赖氨酰内切酶(rLys-C)
作为丝氨酸蛋白酶,该酶具有极强的特异性,仅在赖氨酸残基的 C 末端切割肽键。由于赖氨酸在蛋白质中的出现频率低于胰蛋白酶的主要切割位点(精氨酸 R 和赖氨酸 K),其酶解产物多为较长肽段。在实际应用中,rLys-C 常与胰蛋白酶联用,先经 rLys-C 初步消化,再用胰蛋白酶进一步切割,可显著提升酶解覆盖度,尤其适用于膜蛋白、难溶蛋白等难处理样本的分析。此外,该酶还广泛应用于蛋白质质谱分析、胰岛素类似物生产及肽图谱制作。其重组表达特性赋予了无动物源性污染,最适反应 pH 为 9.0-9.5。
(二)重组胰蛋白酶
胰蛋白酶是目前应用最广泛的蛋白质酶解工具酶,特异性切割精氨酸(R)和赖氨酸(K)残基的 C 末端肽键,且不切割被脯氨酸(P)紧随其后的 R/K 位点。其酶解产生的肽段长度多在 500-2500 Da 范围内,完美匹配质谱分析的需求。在蛋白质组学、测序鉴定及翻译后修饰分析中,胰蛋白酶均为优选酶类。
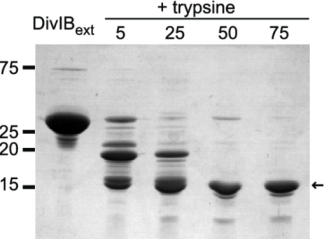
胰蛋白酶酶切DivIB胞外片段
(三)测序级重组糜蛋白酶
该酶为丝氨酸内肽酶,选择性切割Tyr/Phe/Trp残基的 C 末端,最适 pH 为 7.0-9.0。与胰蛋白酶形成互补,可提高富含疏水氨基酸区域的序列覆盖度,生成重叠肽段用于从头测序或序列确认,在蛋白质组学研究中作为胰蛋白酶的补充工具。2-8℃条件下可稳定 24 个月,适用于蛋白测序、抗体轻链分析等场景 。
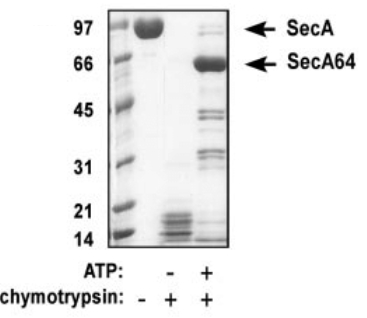
ATP添加下糜蛋白酶对SecA的不完全酶切
(四)重组羧肽酶 B(CPB)
测序级重组羧肽酶 B(CPB)是一种 Zn²⁺金属蛋白酶,特异性从蛋白质或肽的 C 末端依次切除碱性氨基酸(精氨酸 R、赖氨酸 K)。其核心应用包括三个方面:一是 C 末端测序,与质谱联用通过监测随时间释放的氨基酸可确定 C 末端序列;二是重组蛋白加工,去除表达产物 C 端额外带有的精氨酸 / 赖氨酸(来自标签序列),实现蛋白的精准修饰;三是胰岛素前体加工研究,用于模拟生理加工过程。在实际应用中,CPB 常用于抗体碱性峰检测与 C 端序列分析,是生物制药中蛋白精准修饰的关键工具。
(五)重组 N - 糖苷酶 F(PNGase F)
糖基化是蛋白质重要的翻译后修饰,对蛋白质的结构与功能具有关键影响,而重组 N - 糖苷酶 F(PNGase F)是 N - 糖基化分析的核心工具酶。
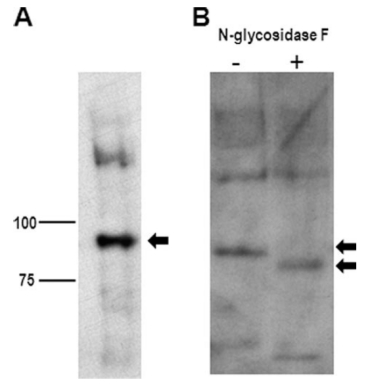
重组 N - 糖苷酶 F处理效果
PNGase F 能够特异性水解天冬酰胺(Asn)与 N-聚糖之间的酰胺键,可裂解几乎所有类型的哺乳动物 N-聚糖,仅对核心 ɑ1-3 岩藻糖修饰的 N-聚糖无活性。其作用机制是将完整的糖链释放,并将连接位点的天冬酰胺转化为天冬氨酸(Asp)。这一特性为糖基化分析提供了多方面的支持:在去糖基化方面,PNGase F 能够从糖蛋白上移除 N-聚糖,从而简化质谱鉴定并提高酶解效率;在糖基化位点鉴定中,去糖基化导致原糖基化位点的 Asn 转变为 Asp,在质谱分析中引起质量数增加,有助于精确定位修饰位点;在聚糖结构分析中,释放出的完整聚糖可进一步通过质谱、HPLC 等技术解析其结构。得益于重组表达技术,PNGase F 已成为糖蛋白去糖基化、抗体糖型分析等研究中的关键工具酶。
(六)胃蛋白酶
作为酸性天冬氨酸蛋白酶,胃蛋白酶的切割位点较为广泛,偏好疏水性氨基酸或芳香族氨基酸周围的肽键,其最适活性 pH 为 1.0-5.0,在酸性条件下表现出优异的稳定性。核心应用包括蛋白质结构分析(非变性条件下产生较大片段以研究结构域)、抗体工程(制备抗体 F (ab') )、血清制品消化、疫苗生产及质谱前处理。
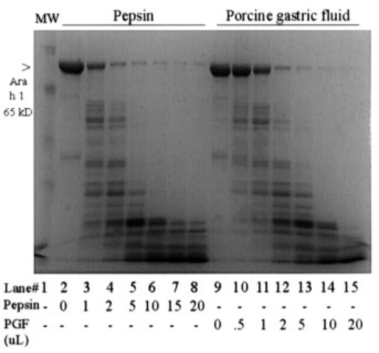
胃蛋白酶消化
详询西宝生物产品,请咨询:400-021-8158 / 021-50272975。
货号 | CAS | 产品 |
EXK0369F | 72561-05-8 | 重组赖氨酰内切酶(rLys-C) |
DCE0060Z | 9002-07-7 | 重组胰蛋白酶 |
| DYY0313E | 9004-07-3 | 重组糜蛋白酶 |
| DBY0114C | 9025-24-5 | 重组羧肽酶B |
ECE0441H | 83534-39-8 | 重组N-糖苷酶 F |
DCE0115J | 9001-75-6 | 胃蛋白酶(猪胃粘膜) |
二、应用场景
蛋白质组学研究:胰蛋白酶、rLys-C 及糜蛋白酶等多种蛋白酶可联合使用,通过互补的酶切特性实现蛋白质的高效、全面酶解,从而为质谱分析提供覆盖度更广、质量更高的肽段片段;
蛋白质测序与鉴定:涵盖 N 端、C 端及内部肽段序列分析,常用 rLys-C、胰蛋白酶等进行特异性酶切,结合羧肽酶 B 等工具酶辅助完成 C 端序列鉴定。
翻译后修饰分析:PNGase F 用于 N-连接聚糖的去除,以解析 N-糖基化位点。
生物制药:应用于胰岛素类似物的酶法制备、抗体工程(如 Fab 片段生成、糖基化表征)以及重组蛋白的精确酶促修饰等关键工艺步骤。
结构生物学研究:胃蛋白酶可用于蛋白质有限酶切,进而分析其结构域组成及研究蛋白质构象与折叠状态。
参考
1. Soizic Masson, et al. Central Domain of DivIB Caps the C-terminal Regions of the FtsL/DivIC Coiled-coil Rod. DOI: 10.1074/jbc.M109.019471
2. A Price, et al. Separable ATPase and membrane insertion domains of the SecA subunit of preprotein translocase.J Biol Chem. 1996 Dec 6;271(49):31580-4
3. Randall A. Kopper, et al. Peanut protein allergens: Gastric digestion is carried out exclusively by pepsin. DOI: 10.1016/j.jaci.2004.05.012
4. Bianca C. Bernardo, et al. Cartilage Intermediate Layer Protein 2 (CILP-2) Is Expressed in Articular and Meniscal Cartilage and Down-regulated in Experimental Osteoarthritis. J Biol Chem. 2011 Oct 28;286(43):37758-67
在蛋白质组学、生物制药开发及翻译后修饰分析等前沿生物研究领域中,高特异性、高纯度的工具酶发挥着不可或缺的关键作用。随着重组DNA技术的不断进步,重组工具酶凭借其显著性能优势,正逐步取代传统动物源酶,成为科研探索与工业生产的核心试剂。
西宝生物布局高纯度重组工具酶赛道,依托在重组蛋白技术领域的深厚积累,重点开发一系列高特异性、测序级别的重组工具酶产品。以卓越的批次间稳定性和可扩展性,满足从基础科研到大规模工业化生产对关键试剂日益增长的需求,彰显了公司赋能生物医药产业链的决心与实力。
一、蛋白酶类:蛋白质酶解的核心工具
蛋白酶类的核心功能是将完整蛋白质切割为适合分析的肽段,其切割特异性直接决定了酶解效果与后续分析的准确性。
(一)测序级重组赖氨酰内切酶(rLys-C)
作为丝氨酸蛋白酶,该酶具有极强的特异性,仅在赖氨酸残基的 C 末端切割肽键。由于赖氨酸在蛋白质中的出现频率低于胰蛋白酶的主要切割位点(精氨酸 R 和赖氨酸 K),其酶解产物多为较长肽段。在实际应用中,rLys-C 常与胰蛋白酶联用,先经 rLys-C 初步消化,再用胰蛋白酶进一步切割,可显著提升酶解覆盖度,尤其适用于膜蛋白、难溶蛋白等难处理样本的分析。此外,该酶还广泛应用于蛋白质质谱分析、胰岛素类似物生产及肽图谱制作。其重组表达特性赋予了无动物源性污染,最适反应 pH 为 9.0-9.5。
(二)重组胰蛋白酶
胰蛋白酶是目前应用最广泛的蛋白质酶解工具酶,特异性切割精氨酸(R)和赖氨酸(K)残基的 C 末端肽键,且不切割被脯氨酸(P)紧随其后的 R/K 位点。其酶解产生的肽段长度多在 500-2500 Da 范围内,完美匹配质谱分析的需求。在蛋白质组学、测序鉴定及翻译后修饰分析中,胰蛋白酶均为优选酶类。

胰蛋白酶酶切DivIB胞外片段
(三)测序级重组糜蛋白酶
该酶为丝氨酸内肽酶,选择性切割Tyr/Phe/Trp残基的 C 末端,最适 pH 为 7.0-9.0。与胰蛋白酶形成互补,可提高富含疏水氨基酸区域的序列覆盖度,生成重叠肽段用于从头测序或序列确认,在蛋白质组学研究中作为胰蛋白酶的补充工具。2-8℃条件下可稳定 24 个月,适用于蛋白测序、抗体轻链分析等场景 。

ATP添加下糜蛋白酶对SecA的不完全酶切
(四)重组羧肽酶 B(CPB)
测序级重组羧肽酶 B(CPB)是一种 Zn²⁺金属蛋白酶,特异性从蛋白质或肽的 C 末端依次切除碱性氨基酸(精氨酸 R、赖氨酸 K)。其核心应用包括三个方面:一是 C 末端测序,与质谱联用通过监测随时间释放的氨基酸可确定 C 末端序列;二是重组蛋白加工,去除表达产物 C 端额外带有的精氨酸 / 赖氨酸(来自标签序列),实现蛋白的精准修饰;三是胰岛素前体加工研究,用于模拟生理加工过程。在实际应用中,CPB 常用于抗体碱性峰检测与 C 端序列分析,是生物制药中蛋白精准修饰的关键工具。
(五)重组 N - 糖苷酶 F(PNGase F)
糖基化是蛋白质重要的翻译后修饰,对蛋白质的结构与功能具有关键影响,而重组 N - 糖苷酶 F(PNGase F)是 N - 糖基化分析的核心工具酶。

重组 N - 糖苷酶 F处理效果
PNGase F 能够特异性水解天冬酰胺(Asn)与 N-聚糖之间的酰胺键,可裂解几乎所有类型的哺乳动物 N-聚糖,仅对核心 ɑ1-3 岩藻糖修饰的 N-聚糖无活性。其作用机制是将完整的糖链释放,并将连接位点的天冬酰胺转化为天冬氨酸(Asp)。这一特性为糖基化分析提供了多方面的支持:在去糖基化方面,PNGase F 能够从糖蛋白上移除 N-聚糖,从而简化质谱鉴定并提高酶解效率;在糖基化位点鉴定中,去糖基化导致原糖基化位点的 Asn 转变为 Asp,在质谱分析中引起质量数增加,有助于精确定位修饰位点;在聚糖结构分析中,释放出的完整聚糖可进一步通过质谱、HPLC 等技术解析其结构。得益于重组表达技术,PNGase F 已成为糖蛋白去糖基化、抗体糖型分析等研究中的关键工具酶。
(六)胃蛋白酶
作为酸性天冬氨酸蛋白酶,胃蛋白酶的切割位点较为广泛,偏好疏水性氨基酸或芳香族氨基酸周围的肽键,其最适活性 pH 为 1.0-5.0,在酸性条件下表现出优异的稳定性。核心应用包括蛋白质结构分析(非变性条件下产生较大片段以研究结构域)、抗体工程(制备抗体 F (ab') )、血清制品消化、疫苗生产及质谱前处理。

胃蛋白酶消化
详询西宝生物产品,请咨询:400-021-8158 / 021-50272975。
货号 | CAS | 产品 |
EXK0369F | 72561-05-8 | 重组赖氨酰内切酶(rLys-C) |
DCE0060Z | 9002-07-7 | 重组胰蛋白酶 |
| DYY0313E | 9004-07-3 | 重组糜蛋白酶 |
| DBY0114C | 9025-24-5 | 重组羧肽酶B |
ECE0441H | 83534-39-8 | 重组N-糖苷酶 F |
DCE0115J | 9001-75-6 | 胃蛋白酶(猪胃粘膜) |
二、应用场景
蛋白质组学研究:胰蛋白酶、rLys-C 及糜蛋白酶等多种蛋白酶可联合使用,通过互补的酶切特性实现蛋白质的高效、全面酶解,从而为质谱分析提供覆盖度更广、质量更高的肽段片段;
蛋白质测序与鉴定:涵盖 N 端、C 端及内部肽段序列分析,常用 rLys-C、胰蛋白酶等进行特异性酶切,结合羧肽酶 B 等工具酶辅助完成 C 端序列鉴定。
翻译后修饰分析:PNGase F 用于 N-连接聚糖的去除,以解析 N-糖基化位点。
生物制药:应用于胰岛素类似物的酶法制备、抗体工程(如 Fab 片段生成、糖基化表征)以及重组蛋白的精确酶促修饰等关键工艺步骤。
结构生物学研究:胃蛋白酶可用于蛋白质有限酶切,进而分析其结构域组成及研究蛋白质构象与折叠状态。
参考
1. Soizic Masson, et al. Central Domain of DivIB Caps the C-terminal Regions of the FtsL/DivIC Coiled-coil Rod. DOI: 10.1074/jbc.M109.019471
2. A Price, et al. Separable ATPase and membrane insertion domains of the SecA subunit of preprotein translocase.J Biol Chem. 1996 Dec 6;271(49):31580-4
3. Randall A. Kopper, et al. Peanut protein allergens: Gastric digestion is carried out exclusively by pepsin. DOI: 10.1016/j.jaci.2004.05.012
4. Bianca C. Bernardo, et al. Cartilage Intermediate Layer Protein 2 (CILP-2) Is Expressed in Articular and Meniscal Cartilage and Down-regulated in Experimental Osteoarthritis. J Biol Chem. 2011 Oct 28;286(43):37758-67



