摘要:本研究首次系统揭示了由CASP8基因GGGAGA重复扩展驱动的多聚甘氨酸-精氨酸(polyGR)蛋白聚集物在AD脑组织中的高频存在。
阿尔茨海默病(Alzheimer’s disease, AD)作为最常见的痴呆类型,其经典病理特征包括β-淀粉样蛋白(Aβ)斑块和tau蛋白过度磷酸化(pTau)形成的神经原纤维缠结。然而,约95%的散发性晚发性AD(LOAD)病例的分子驱动机制仍不明确。近年来,除Aβ和tau外,其他蛋白质聚集现象(如TDP-43、α-突触核蛋白)也被发现与AD病理共存,提示AD具有复杂的多蛋白质opathy特征。在此背景下,研究者将目光投向一类新型病理聚集物——多聚甘氨酸-精氨酸(polyGR)蛋白。此前研究已知,在C9orf72基因突变相关的肌萎缩侧索硬化/额颞叶痴呆(C9-ALS/FTD)中,polyGR可通过重复关联非AUG翻译(RAN translation)产生并具有强神经毒性。但polyGR是否在AD中广泛存在及其与AD典型病理的关联尚属未知。
为回答这一问题,研究团队整合来自美国佛罗里达AD研究中心、约翰霍普金斯大学和明尼苏达大学脑库的195例尸脑样本(含156例AD、26例年龄匹配对照和13例原发性年龄相关tauopathy(PART)病例),通过免疫组化(IHC)、Western blot、细胞转染及氧化应激模型等多技术手段,系统性探索了polyGR+聚集物的病理意义。

图1 含有PolyGR的蛋白聚集物与阿尔茨海默病的病理及临床表现相关
关键技术方法概述
研究主要依托以下方法展开:
1.1. 多中心尸脑队列设计:涵盖3个独立AD队列的海马组织切片,确保结果可重复性。
2.2. 免疫组化与定量分析:采用特异性polyGR抗体(H3148)及Aβ(Ab5)、pTau(AT8)抗体染色,通过QuPath软件进行全切片定量。
3.3. 分子生物学实验:构建CASP8-GGGAGAEXP迷你基因载体(p-AD-R1、p-C-Var),转染SH-SY5Y细胞,模拟polyGR表达及tau磷酸化过程。
4.4. 氧化应激干预:使用H2O2处理细胞,观察polyGR蛋白水平及pTau积累变化。
5.5. 基因分型与病理关联分析:对APOE、TREM2等9个AD风险SNPs进行基因分型,并结合临床数据(如卒中、高血压史)进行统计学关联检验。
研究结果
1. polyGR+聚集物在AD海马体中高频出现且具有特定分布模式
在三队列中,约60%的AD脑样本海马区(CA、齿状回、下托)检测到polyGR+聚集信号,而对照和PART病例均无此现象。聚集形态可分为四类:胞质弥漫型(88%)、核点状(4%)、齿状回特异性(24%)以及簇状点状(59%)。其中,簇状点状聚集与营养不良神经突标记物(如LAMP1)共定位,且该类AD患者发病年龄更早(68.5岁 vs 76岁)、死亡年龄更低(78岁 vs 81岁),提示其特殊毒性。
2. polyGR+聚集水平与AD神经病理改变(ADNC)严重程度正相关
PolyGR+面积与Aβ斑块(r=0.568)和pTau(r=0.538)负荷显著相关。高polyGR组(阈值:海马区面积占比≥0.00010371)的Aβ和pTau水平分别为低组的1.76倍和2.76倍。此外,Thal V期(Aβ广泛扩散)及Braak V-VI期(tau广泛缠结)的AD脑polyGR信号更强,且CERAD评分“频繁”的神经炎斑组polyGR水平显著高于无斑组。
3. polyGR+聚集与共存病理(LATE-NC、LBP)无整体关联但可共定位
尽管海马polyGR总量在LATE-NC(TDP-43病理)或路易体病理(LBP)阳性/阴性组间无差异,但双标染色显示部分神经元中polyGR与pTDP-43或α-突触核蛋白包涵体共存,提示局部相互作用可能性。
4. AD风险基因与非遗传因素影响polyGR积累
在LOAD病例中,APOE4等位基因携带者海马polyGR信号升高约2.5倍;一例TREM2风险变异携带者亦呈现高polyGR水平。此外,有卒中史或高血压(HBP)的LOAD患者polyGR水平分别为无脑损伤史组的3.8倍和3.71倍,而Aβ/pTau未同步升高,提示polyGR可能独立响应血管性应激。
5. 氧化应激直接促进CASP8来源polyGR表达并加剧tau磷酸化
在SH-SY5Y模型中,H2O2处理使CASP8-GGGAGAEXP转染细胞的polyGR蛋白量增加27%,并进一步使polyGR诱导的pTau(S202/T205)水平升高51%,而空载体对照组无此效应。这表明氧化应激可特异性放大CASP8重复扩展的分子毒性。
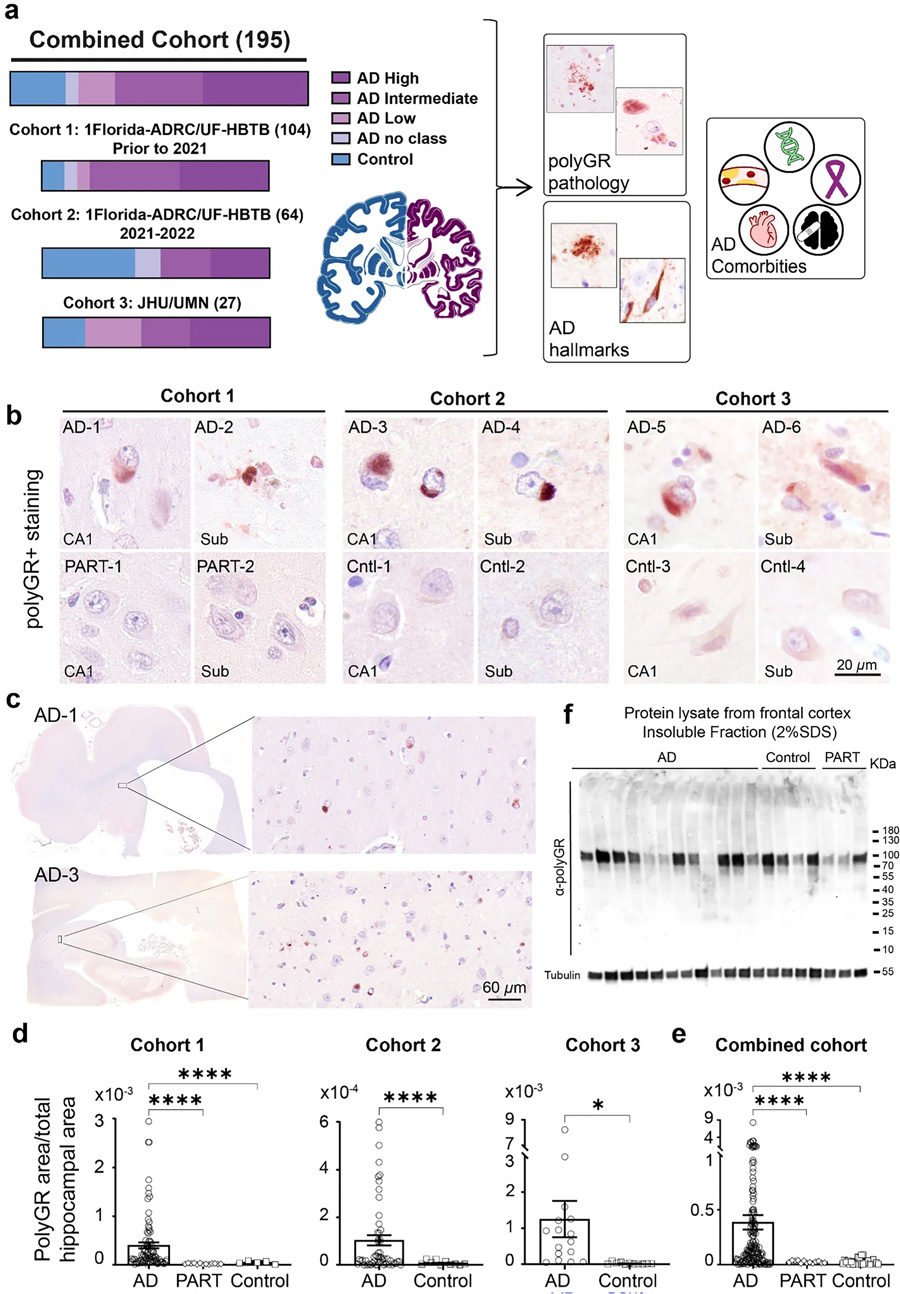
图2 在多组阿尔茨海默病尸检脑样本中,海马体频繁检测到PolyGR+ 蛋白聚集物
结论与意义
本研究首次在多中心AD队列中证实polyGR+聚集是一种频繁且未被充分认识的蛋白质opathy,其水平与AD核心病理(Aβ、pTau)严重程度及疾病进展指标(如早发、生存期缩短)紧密关联。更重要的是,研究揭示了polyGR积累受遗传(APOE4)和非遗传风险因素(卒中、高血压)调控,并通过细胞实验证明氧化应激可直接增强CASP8来源polyGR的表达及tau病理。这些发现不仅将AD与RAN翻译病理机制联系起来,还为理解血管性风险因素如何通过蛋白质聚集途径推动AD发病提供了新范式。未来针对polyGR产生通路(如CASP8重复扩展、整合应激反应)的干预可能成为AD治疗的新策略。
参考资料
[1] Genome-scale CRISPR screens identify PTGES3 as a direct modulator of androgen receptor function in advanced prostate cancer
摘要:本研究首次系统揭示了由CASP8基因GGGAGA重复扩展驱动的多聚甘氨酸-精氨酸(polyGR)蛋白聚集物在AD脑组织中的高频存在。
阿尔茨海默病(Alzheimer’s disease, AD)作为最常见的痴呆类型,其经典病理特征包括β-淀粉样蛋白(Aβ)斑块和tau蛋白过度磷酸化(pTau)形成的神经原纤维缠结。然而,约95%的散发性晚发性AD(LOAD)病例的分子驱动机制仍不明确。近年来,除Aβ和tau外,其他蛋白质聚集现象(如TDP-43、α-突触核蛋白)也被发现与AD病理共存,提示AD具有复杂的多蛋白质opathy特征。在此背景下,研究者将目光投向一类新型病理聚集物——多聚甘氨酸-精氨酸(polyGR)蛋白。此前研究已知,在C9orf72基因突变相关的肌萎缩侧索硬化/额颞叶痴呆(C9-ALS/FTD)中,polyGR可通过重复关联非AUG翻译(RAN translation)产生并具有强神经毒性。但polyGR是否在AD中广泛存在及其与AD典型病理的关联尚属未知。
为回答这一问题,研究团队整合来自美国佛罗里达AD研究中心、约翰霍普金斯大学和明尼苏达大学脑库的195例尸脑样本(含156例AD、26例年龄匹配对照和13例原发性年龄相关tauopathy(PART)病例),通过免疫组化(IHC)、Western blot、细胞转染及氧化应激模型等多技术手段,系统性探索了polyGR+聚集物的病理意义。

图1 含有PolyGR的蛋白聚集物与阿尔茨海默病的病理及临床表现相关
关键技术方法概述
研究主要依托以下方法展开:
1.1. 多中心尸脑队列设计:涵盖3个独立AD队列的海马组织切片,确保结果可重复性。
2.2. 免疫组化与定量分析:采用特异性polyGR抗体(H3148)及Aβ(Ab5)、pTau(AT8)抗体染色,通过QuPath软件进行全切片定量。
3.3. 分子生物学实验:构建CASP8-GGGAGAEXP迷你基因载体(p-AD-R1、p-C-Var),转染SH-SY5Y细胞,模拟polyGR表达及tau磷酸化过程。
4.4. 氧化应激干预:使用H2O2处理细胞,观察polyGR蛋白水平及pTau积累变化。
5.5. 基因分型与病理关联分析:对APOE、TREM2等9个AD风险SNPs进行基因分型,并结合临床数据(如卒中、高血压史)进行统计学关联检验。
研究结果
1. polyGR+聚集物在AD海马体中高频出现且具有特定分布模式
在三队列中,约60%的AD脑样本海马区(CA、齿状回、下托)检测到polyGR+聚集信号,而对照和PART病例均无此现象。聚集形态可分为四类:胞质弥漫型(88%)、核点状(4%)、齿状回特异性(24%)以及簇状点状(59%)。其中,簇状点状聚集与营养不良神经突标记物(如LAMP1)共定位,且该类AD患者发病年龄更早(68.5岁 vs 76岁)、死亡年龄更低(78岁 vs 81岁),提示其特殊毒性。
2. polyGR+聚集水平与AD神经病理改变(ADNC)严重程度正相关
PolyGR+面积与Aβ斑块(r=0.568)和pTau(r=0.538)负荷显著相关。高polyGR组(阈值:海马区面积占比≥0.00010371)的Aβ和pTau水平分别为低组的1.76倍和2.76倍。此外,Thal V期(Aβ广泛扩散)及Braak V-VI期(tau广泛缠结)的AD脑polyGR信号更强,且CERAD评分“频繁”的神经炎斑组polyGR水平显著高于无斑组。
3. polyGR+聚集与共存病理(LATE-NC、LBP)无整体关联但可共定位
尽管海马polyGR总量在LATE-NC(TDP-43病理)或路易体病理(LBP)阳性/阴性组间无差异,但双标染色显示部分神经元中polyGR与pTDP-43或α-突触核蛋白包涵体共存,提示局部相互作用可能性。
4. AD风险基因与非遗传因素影响polyGR积累
在LOAD病例中,APOE4等位基因携带者海马polyGR信号升高约2.5倍;一例TREM2风险变异携带者亦呈现高polyGR水平。此外,有卒中史或高血压(HBP)的LOAD患者polyGR水平分别为无脑损伤史组的3.8倍和3.71倍,而Aβ/pTau未同步升高,提示polyGR可能独立响应血管性应激。
5. 氧化应激直接促进CASP8来源polyGR表达并加剧tau磷酸化
在SH-SY5Y模型中,H2O2处理使CASP8-GGGAGAEXP转染细胞的polyGR蛋白量增加27%,并进一步使polyGR诱导的pTau(S202/T205)水平升高51%,而空载体对照组无此效应。这表明氧化应激可特异性放大CASP8重复扩展的分子毒性。

图2 在多组阿尔茨海默病尸检脑样本中,海马体频繁检测到PolyGR+ 蛋白聚集物
结论与意义
本研究首次在多中心AD队列中证实polyGR+聚集是一种频繁且未被充分认识的蛋白质opathy,其水平与AD核心病理(Aβ、pTau)严重程度及疾病进展指标(如早发、生存期缩短)紧密关联。更重要的是,研究揭示了polyGR积累受遗传(APOE4)和非遗传风险因素(卒中、高血压)调控,并通过细胞实验证明氧化应激可直接增强CASP8来源polyGR的表达及tau病理。这些发现不仅将AD与RAN翻译病理机制联系起来,还为理解血管性风险因素如何通过蛋白质聚集途径推动AD发病提供了新范式。未来针对polyGR产生通路(如CASP8重复扩展、整合应激反应)的干预可能成为AD治疗的新策略。
参考资料
[1] Genome-scale CRISPR screens identify PTGES3 as a direct modulator of androgen receptor function in advanced prostate cancer



