摘要:研究表明J17能有效恢复AD模型小鼠血液和脑内丁酸水平,改善认知障碍,减少Aβ沉积和小胶质细胞过度活化。
当人类寿命不断延长,阿尔茨海默病(Alzheimer's disease, AD)已成为困扰全球的公共卫生挑战。这种最常见的神经退行性疾病以进行性认知衰退为特征,目前缺乏有效治疗方法。AD的神经病理特征包括细胞外淀粉样斑块、神经纤维缠结、神经炎症和神经元丢失。其中,淀粉样蛋白β(amyloid β, Aβ)作为淀粉样斑块的主要成分,其异常沉积被认为是AD发病的核心环节。Aβ是由淀粉样前体蛋白(amyloid precursor protein, APP)经β-分泌酶BACE1和γ-分泌酶顺序切割产生。当APP加工过程失调,Aβ生成增加,同时小胶质细胞清除功能受损,共同导致Aβ沉积。更棘手的是,Aβ沉积又会激活小胶质细胞,引发神经炎症反应,形成恶性循环。
近年来,肠道菌群及其代谢产物在AD发病中的作用日益受到关注。在众多微生物代谢产物中,丁酸(butyrate)展现出对AD的潜在益处。然而,如何提高丁酸的生物利用度是实现其临床应用的关键挑战。为了解决这一难题,研究团队另辟蹊径,开发了一种工程化的产丁酸酿酒酵母(Saccharomyces cerevisiae)菌株J17。这种酵母益生菌有望通过丁酸补充和底盘益生功能的协同作用,改善AD相关表型。

图1 肥胖重塑脂肪组织中CD8+ T细胞的铁代谢以加剧代谢性炎症
为验证这一创新策略,研究人员首先检测了AD模型小鼠APP23/PS45中丁酸水平的变化。结果显示,与野生型(WT)小鼠相比,AD模型小鼠血液和脑内的丁酸水平分别显著降低至53.99±6.90%和28.92±2.92%,这一现象与AD患者及其他两种AD模型小鼠(APP/PS1和3xTg)中的发现一致。引人注目的是,J17干预成功恢复了AD小鼠血液和脑内的丁酸水平,而底盘菌株BY4741则无此效果。
在认知功能评估方面,J17表现出显著改善效果。莫里斯水迷宫(Morris water maze, MWM)测试中,可见平台试验第一天四组小鼠的逃避潜伏期无差异。在随后四天的隐藏平台试验中,J17处理的AD小鼠逃避潜伏期显著缩短,第五天时从50.20±6.64秒降至27.82±5.86秒,与野生型小鼠水平(30.01±4.70秒)相当。在最后一天的探查试验中,J17处理的AD小鼠在目标象限的游泳距离也显著长于未处理的AD小鼠。值得注意的是,BY4741处理的AD小鼠也表现出改善趋势,但无统计学显著性。这些结果证明J17能挽救AD小鼠的学习记忆缺陷。
对Aβ沉积的进一步分析显示,J17显著减少了AD小鼠皮层和海马中Aβ斑块的数量和面积。在皮层,斑块数量从10.06±3.21/mm2降至5.70±2.20/mm2,面积从1.44±0.43%降至0.68±0.13%;在海马,数量从7.31±1.57/mm2降至4.03±1.64/mm2,面积从1.14±0.48%降至0.49±0.10%。BY4741处理组也观察到Aβ斑块减少趋势,但差异不显著。机制研究表明,J17通过降低APP、BACE1和CTFβ水平,抑制BACE1介导的APPβ-剪切,从而减少Aβ42生成和斑块形成。
除减少Aβ生成外,增强Aβ清除也是J17的作用机制。研究发现J17减轻了AD小鼠小胶质细胞活化,表现为离子钙结合适配器分子1(Iba-1)染色减少。同时,J17将皮层中促炎细胞因子TNF-α、IL-1β和IL-6水平分别降至74.85±15.56%、66.91±11.74%和71.45±14.29%,而抗炎细胞因子IL-10水平升至135.63±6.84%。海马区也观察到一致变化。这表明J17通过减轻小胶质细胞过度活化和神经炎症,促进小胶质细胞介导的Aβ清除。
此外,J17重塑了AD小鼠的肠道菌群,降低了炎症和神经毒性相关代谢物水平,表明J17有利于维持AD小鼠健康的肠道环境,这可能有助于缓解AD相关表型。
本研究主要采用了以下关键技术方法:使用APP23/PS45转基因AD模型小鼠进行干预研究;通过Morris水迷宫实验评估认知功能;采用免疫荧光染色检测Aβ斑块和小胶质细胞标志物Iba-1;通过酶联免疫吸附试验(ELISA)测定细胞因子水平;利用16S rRNA测序和非靶向代谢组学分析肠道菌群和代谢物变化。
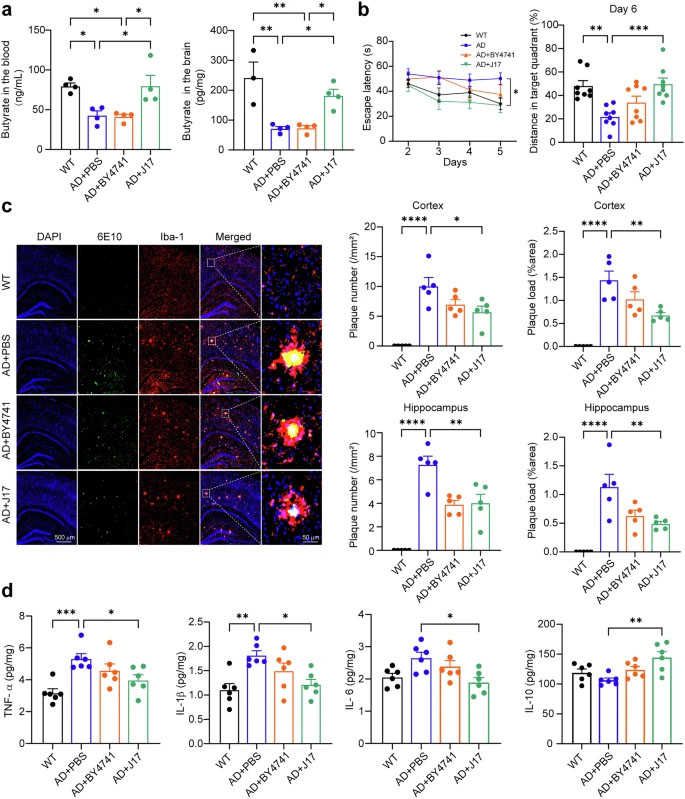
图2 工程化产丁酸酵母(J17)可纠正丁酸缺乏,并改善APP23/PS45小鼠的阿尔茨海默症相关表型
J17挽救丁酸缺陷并改善APP23/PS45小鼠AD相关表型
研究人员首先证实了AD模型小鼠存在系统性丁酸缺乏,而J17干预能有效恢复血液和脑内丁酸水平。在认知功能方面,J17显著改善了AD小鼠在莫里斯水迷宫测试中的表现,缩短逃避潜伏期,增加目标象限游泳距离。
J17减轻Aβ沉积并调节APP加工
通过免疫荧光染色发现,J17显著减少了皮层和海马区Aβ斑块的数量和面积。机制研究表明,J17降低了APP、BACE1和CTFβ蛋白水平,抑制BACE1介导的APPβ-剪切通路,从而减少Aβ42生成。
J17减轻小胶质细胞过度活化和神经炎症
J17处理降低了小胶质细胞标志物Iba-1的表达,调节炎症因子平衡,降低TNF-α、IL-1β和IL-6等促炎因子水平,提高抗炎因子IL-10水平,表明J17能缓解神经炎症反应。
J17重塑肠道菌群
研究还发现J17能调节AD小鼠肠道菌群组成,降低炎症和神经毒性相关代谢物,改善肠道微环境,这可能是其发挥益生效应的另一重要途径。
本研究证实工程化产丁酸酵母J17能通过多种机制缓解AD相关病理表型。值得注意的是,虽然底盘菌株BY4741也显示出改善AD表型的趋势,但未改变丁酸水平,且效果无统计学显著性,强烈提示J17的益处来自于丁酸补充和益生功能的协同效应。与粪便微生物移植相比,J17给药具有避免未知或条件性病原体潜在风险的优势。然而,J17的剂量效应和长期效果仍需进一步研究。
该研究成果发表于《Signal Transduction and Targeted Therapy》,为AD治疗提供了新的思路和策略,即通过工程微生物靶向肠道-脑轴,实现神经退行性疾病的干预。这种微生物疗法策略具有重要转化医学价值,为开发AD新型治疗方法开辟了道路。
参考资料
[1] Engineered butyrate-producing yeasts mitigate Alzheimer-associated phenotypes
摘要:研究表明J17能有效恢复AD模型小鼠血液和脑内丁酸水平,改善认知障碍,减少Aβ沉积和小胶质细胞过度活化。
当人类寿命不断延长,阿尔茨海默病(Alzheimer's disease, AD)已成为困扰全球的公共卫生挑战。这种最常见的神经退行性疾病以进行性认知衰退为特征,目前缺乏有效治疗方法。AD的神经病理特征包括细胞外淀粉样斑块、神经纤维缠结、神经炎症和神经元丢失。其中,淀粉样蛋白β(amyloid β, Aβ)作为淀粉样斑块的主要成分,其异常沉积被认为是AD发病的核心环节。Aβ是由淀粉样前体蛋白(amyloid precursor protein, APP)经β-分泌酶BACE1和γ-分泌酶顺序切割产生。当APP加工过程失调,Aβ生成增加,同时小胶质细胞清除功能受损,共同导致Aβ沉积。更棘手的是,Aβ沉积又会激活小胶质细胞,引发神经炎症反应,形成恶性循环。
近年来,肠道菌群及其代谢产物在AD发病中的作用日益受到关注。在众多微生物代谢产物中,丁酸(butyrate)展现出对AD的潜在益处。然而,如何提高丁酸的生物利用度是实现其临床应用的关键挑战。为了解决这一难题,研究团队另辟蹊径,开发了一种工程化的产丁酸酿酒酵母(Saccharomyces cerevisiae)菌株J17。这种酵母益生菌有望通过丁酸补充和底盘益生功能的协同作用,改善AD相关表型。

图1 肥胖重塑脂肪组织中CD8+ T细胞的铁代谢以加剧代谢性炎症
为验证这一创新策略,研究人员首先检测了AD模型小鼠APP23/PS45中丁酸水平的变化。结果显示,与野生型(WT)小鼠相比,AD模型小鼠血液和脑内的丁酸水平分别显著降低至53.99±6.90%和28.92±2.92%,这一现象与AD患者及其他两种AD模型小鼠(APP/PS1和3xTg)中的发现一致。引人注目的是,J17干预成功恢复了AD小鼠血液和脑内的丁酸水平,而底盘菌株BY4741则无此效果。
在认知功能评估方面,J17表现出显著改善效果。莫里斯水迷宫(Morris water maze, MWM)测试中,可见平台试验第一天四组小鼠的逃避潜伏期无差异。在随后四天的隐藏平台试验中,J17处理的AD小鼠逃避潜伏期显著缩短,第五天时从50.20±6.64秒降至27.82±5.86秒,与野生型小鼠水平(30.01±4.70秒)相当。在最后一天的探查试验中,J17处理的AD小鼠在目标象限的游泳距离也显著长于未处理的AD小鼠。值得注意的是,BY4741处理的AD小鼠也表现出改善趋势,但无统计学显著性。这些结果证明J17能挽救AD小鼠的学习记忆缺陷。
对Aβ沉积的进一步分析显示,J17显著减少了AD小鼠皮层和海马中Aβ斑块的数量和面积。在皮层,斑块数量从10.06±3.21/mm2降至5.70±2.20/mm2,面积从1.44±0.43%降至0.68±0.13%;在海马,数量从7.31±1.57/mm2降至4.03±1.64/mm2,面积从1.14±0.48%降至0.49±0.10%。BY4741处理组也观察到Aβ斑块减少趋势,但差异不显著。机制研究表明,J17通过降低APP、BACE1和CTFβ水平,抑制BACE1介导的APPβ-剪切,从而减少Aβ42生成和斑块形成。
除减少Aβ生成外,增强Aβ清除也是J17的作用机制。研究发现J17减轻了AD小鼠小胶质细胞活化,表现为离子钙结合适配器分子1(Iba-1)染色减少。同时,J17将皮层中促炎细胞因子TNF-α、IL-1β和IL-6水平分别降至74.85±15.56%、66.91±11.74%和71.45±14.29%,而抗炎细胞因子IL-10水平升至135.63±6.84%。海马区也观察到一致变化。这表明J17通过减轻小胶质细胞过度活化和神经炎症,促进小胶质细胞介导的Aβ清除。
此外,J17重塑了AD小鼠的肠道菌群,降低了炎症和神经毒性相关代谢物水平,表明J17有利于维持AD小鼠健康的肠道环境,这可能有助于缓解AD相关表型。
本研究主要采用了以下关键技术方法:使用APP23/PS45转基因AD模型小鼠进行干预研究;通过Morris水迷宫实验评估认知功能;采用免疫荧光染色检测Aβ斑块和小胶质细胞标志物Iba-1;通过酶联免疫吸附试验(ELISA)测定细胞因子水平;利用16S rRNA测序和非靶向代谢组学分析肠道菌群和代谢物变化。

图2 工程化产丁酸酵母(J17)可纠正丁酸缺乏,并改善APP23/PS45小鼠的阿尔茨海默症相关表型
J17挽救丁酸缺陷并改善APP23/PS45小鼠AD相关表型
研究人员首先证实了AD模型小鼠存在系统性丁酸缺乏,而J17干预能有效恢复血液和脑内丁酸水平。在认知功能方面,J17显著改善了AD小鼠在莫里斯水迷宫测试中的表现,缩短逃避潜伏期,增加目标象限游泳距离。
J17减轻Aβ沉积并调节APP加工
通过免疫荧光染色发现,J17显著减少了皮层和海马区Aβ斑块的数量和面积。机制研究表明,J17降低了APP、BACE1和CTFβ蛋白水平,抑制BACE1介导的APPβ-剪切通路,从而减少Aβ42生成。
J17减轻小胶质细胞过度活化和神经炎症
J17处理降低了小胶质细胞标志物Iba-1的表达,调节炎症因子平衡,降低TNF-α、IL-1β和IL-6等促炎因子水平,提高抗炎因子IL-10水平,表明J17能缓解神经炎症反应。
J17重塑肠道菌群
研究还发现J17能调节AD小鼠肠道菌群组成,降低炎症和神经毒性相关代谢物,改善肠道微环境,这可能是其发挥益生效应的另一重要途径。
本研究证实工程化产丁酸酵母J17能通过多种机制缓解AD相关病理表型。值得注意的是,虽然底盘菌株BY4741也显示出改善AD表型的趋势,但未改变丁酸水平,且效果无统计学显著性,强烈提示J17的益处来自于丁酸补充和益生功能的协同效应。与粪便微生物移植相比,J17给药具有避免未知或条件性病原体潜在风险的优势。然而,J17的剂量效应和长期效果仍需进一步研究。
该研究成果发表于《Signal Transduction and Targeted Therapy》,为AD治疗提供了新的思路和策略,即通过工程微生物靶向肠道-脑轴,实现神经退行性疾病的干预。这种微生物疗法策略具有重要转化医学价值,为开发AD新型治疗方法开辟了道路。
参考资料
[1] Engineered butyrate-producing yeasts mitigate Alzheimer-associated phenotypes



