摘要:研究团队对大型队列的人类骨髓样本进行了深入的分子和空间分析以揭示突变的HSC克隆如何获得优势。
每一秒,骨髓都会产生数百万个新的血液细胞和免疫细胞。这种持续不断的更新依赖于造血干细胞(HSC)、基质细胞和免疫调节因子之间精妙的合作。
随着时间的推移,这种和谐关系被破坏。衰老、炎症或体细胞突变会扰乱这些细胞之间的通讯,削弱干细胞更新能力,并允许突变的HSC扩增,最终导致不确定潜能的克隆性造血(CHIP)。
尽管CHIP本身无症状,但会使血液癌症的风险增加十倍,心血管疾病和过早死亡的风险翻倍。骨髓增生异常综合征(MDS)就是一种相关的HSC克隆性疾病。在70岁以上人群中,MDS的发病率为万分之二,其中30%的病例会发展为急性髓系白血病(AML)。
尽管骨髓微环境具有重要的临床意义,但人们对其促进这些血液疾病的机制仍知之甚少。

图1 肥胖重塑脂肪组织中CD8+ T细胞的铁代谢以加剧代谢性炎症
为了揭示突变的HSC克隆如何获得优势,欧洲分子生物学实验室(EMBL)和德国美因茨大学领导的研究团队对大型队列的人类骨髓样本进行了深入的分子和空间分析,并将结果发表在《Nature Communications》杂志上。
观察干细胞微环境
研究人员利用单细胞RNA测序、活检成像、蛋白质组学等分析,构建了健康供者(包括CHIP患者)和MDS患者的骨髓微环境高分辨率图谱。
这种综合分析揭示了一种异常的细胞转化,甚至在疾病出现之前就已经开始。研究人员发现了一群炎症性基质细胞(iMSC),它们取代了正常的为干细胞提供支持的间充质基质细胞(MSC)。
与健康的基质细胞不同,这些炎症性基质细胞会释放大量干扰素诱导的细胞因子和趋化因子,吸引并激活干扰素响应性T细胞。这些T细胞反过来又会放大炎症信号,形成一个前馈回路,维持慢性炎症,抑制健康血液生成,并促进血管重塑。
探究骨髓炎症的驱动因素
有趣的是,科学家们并未发现证据,说明MDS中突变的造血细胞本身驱动了炎症。他们采用了一种名为SpliceUp的新型计算工具,该工具能够区分单细胞数据中的突变细胞和非突变细胞。这更加凸显了骨髓微环境在疾病进展中的重要性。
共同第一作者、EMBL的博士后研究员Karin Prummel表示:“令人惊讶的是,MDS阶段的干细胞无法触发基质细胞产生CXCL12,这是一种重要的信号分子,可引导血细胞在骨髓中定植。这种缺陷或许可以解释骨髓为什么不再正常工作。”
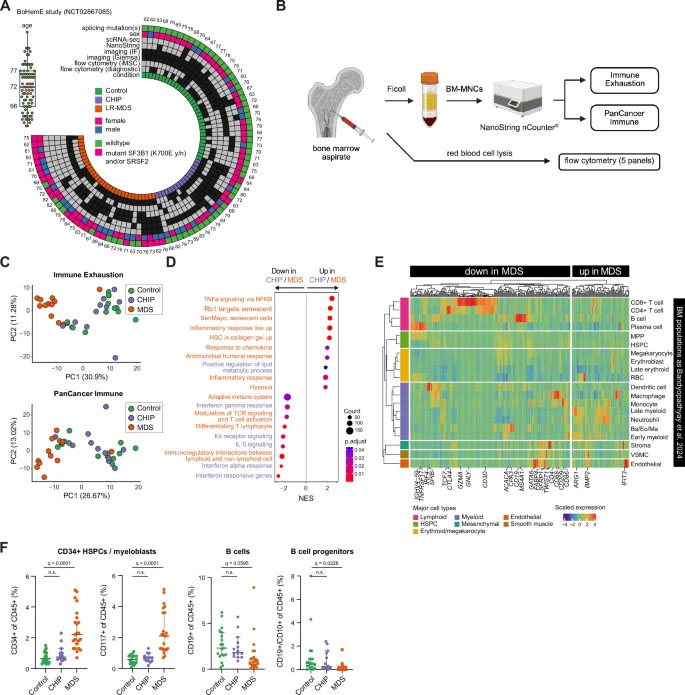
图2 CHIP与MDS整体骨髓炎症表达谱分析
研究人员认为炎症是血液疾病早期阶段的主要驱动力,并确定骨髓微环境为关键治疗靶点。通过将研究重心从突变的干细胞转向维持其存活的细胞生态系统,这项研究提出了新型的预防和治疗策略。
抗炎药物或干扰素调节剂可保护老年CHIP患者的骨髓功能,而靶向药物与微环境疗法的组合有望阻止疾病向MDS或AML进展。iMSC和干扰素响应性T细胞的分子特征还可以作为生物标志物,在临床症状出现前识别高危人群。
共同通讯作者、美因茨大学的Borhane Guezguez指出:“我们的发现表明骨髓微环境主动塑造了恶性演化的早期阶段。随着分子图谱分析技术的进步,我们能够在临床症状出现前数年检测到白血病前期状态。”
理解炎症重塑机制
这项研究不仅拓展了血液学领域的认知,更加深了对炎症性衰老(inflammaging)的理解。这种慢性的低度炎症造成了多种年龄相关性疾病,包括癌症、心血管疾病及代谢性疾病。
骨髓一度被认为是单纯的造血器官,如今却发现是炎症性衰老的驱动因素和治疗靶点。通过阐明免疫-基质相互作用如何促进疾病发展,这些发现为探究其他髓系恶性疾病中的炎症重塑机制提供了框架。
参考资料
[1] Inflammatory stromal and T cells mediate human bone marrow niche remodeling in clonal hematopoiesis and myelodysplasia
摘要:研究团队对大型队列的人类骨髓样本进行了深入的分子和空间分析以揭示突变的HSC克隆如何获得优势。
每一秒,骨髓都会产生数百万个新的血液细胞和免疫细胞。这种持续不断的更新依赖于造血干细胞(HSC)、基质细胞和免疫调节因子之间精妙的合作。
随着时间的推移,这种和谐关系被破坏。衰老、炎症或体细胞突变会扰乱这些细胞之间的通讯,削弱干细胞更新能力,并允许突变的HSC扩增,最终导致不确定潜能的克隆性造血(CHIP)。
尽管CHIP本身无症状,但会使血液癌症的风险增加十倍,心血管疾病和过早死亡的风险翻倍。骨髓增生异常综合征(MDS)就是一种相关的HSC克隆性疾病。在70岁以上人群中,MDS的发病率为万分之二,其中30%的病例会发展为急性髓系白血病(AML)。
尽管骨髓微环境具有重要的临床意义,但人们对其促进这些血液疾病的机制仍知之甚少。

图1 肥胖重塑脂肪组织中CD8+ T细胞的铁代谢以加剧代谢性炎症
为了揭示突变的HSC克隆如何获得优势,欧洲分子生物学实验室(EMBL)和德国美因茨大学领导的研究团队对大型队列的人类骨髓样本进行了深入的分子和空间分析,并将结果发表在《Nature Communications》杂志上。
观察干细胞微环境
研究人员利用单细胞RNA测序、活检成像、蛋白质组学等分析,构建了健康供者(包括CHIP患者)和MDS患者的骨髓微环境高分辨率图谱。
这种综合分析揭示了一种异常的细胞转化,甚至在疾病出现之前就已经开始。研究人员发现了一群炎症性基质细胞(iMSC),它们取代了正常的为干细胞提供支持的间充质基质细胞(MSC)。
与健康的基质细胞不同,这些炎症性基质细胞会释放大量干扰素诱导的细胞因子和趋化因子,吸引并激活干扰素响应性T细胞。这些T细胞反过来又会放大炎症信号,形成一个前馈回路,维持慢性炎症,抑制健康血液生成,并促进血管重塑。
探究骨髓炎症的驱动因素
有趣的是,科学家们并未发现证据,说明MDS中突变的造血细胞本身驱动了炎症。他们采用了一种名为SpliceUp的新型计算工具,该工具能够区分单细胞数据中的突变细胞和非突变细胞。这更加凸显了骨髓微环境在疾病进展中的重要性。
共同第一作者、EMBL的博士后研究员Karin Prummel表示:“令人惊讶的是,MDS阶段的干细胞无法触发基质细胞产生CXCL12,这是一种重要的信号分子,可引导血细胞在骨髓中定植。这种缺陷或许可以解释骨髓为什么不再正常工作。”

图2 CHIP与MDS整体骨髓炎症表达谱分析
研究人员认为炎症是血液疾病早期阶段的主要驱动力,并确定骨髓微环境为关键治疗靶点。通过将研究重心从突变的干细胞转向维持其存活的细胞生态系统,这项研究提出了新型的预防和治疗策略。
抗炎药物或干扰素调节剂可保护老年CHIP患者的骨髓功能,而靶向药物与微环境疗法的组合有望阻止疾病向MDS或AML进展。iMSC和干扰素响应性T细胞的分子特征还可以作为生物标志物,在临床症状出现前识别高危人群。
共同通讯作者、美因茨大学的Borhane Guezguez指出:“我们的发现表明骨髓微环境主动塑造了恶性演化的早期阶段。随着分子图谱分析技术的进步,我们能够在临床症状出现前数年检测到白血病前期状态。”
理解炎症重塑机制
这项研究不仅拓展了血液学领域的认知,更加深了对炎症性衰老(inflammaging)的理解。这种慢性的低度炎症造成了多种年龄相关性疾病,包括癌症、心血管疾病及代谢性疾病。
骨髓一度被认为是单纯的造血器官,如今却发现是炎症性衰老的驱动因素和治疗靶点。通过阐明免疫-基质相互作用如何促进疾病发展,这些发现为探究其他髓系恶性疾病中的炎症重塑机制提供了框架。
参考资料
[1] Inflammatory stromal and T cells mediate human bone marrow niche remodeling in clonal hematopoiesis and myelodysplasia



