摘要:通过生化与冷冻电镜技术,揭示ZAK激酶在核糖体碰撞中的激活机制。
在细胞内,蛋白质合成是一个高度调控的过程,它不仅涉及遗传信息的准确传递,还与细胞的应激反应密切相关。当翻译过程中出现障碍时,例如mRNA的损伤或营养缺乏,细胞内的核糖体会暂时停滞,这种停滞会导致相邻的核糖体发生碰撞。这种核糖体碰撞不仅是细胞内质量控制机制的触发信号,还与广泛的应激信号通路相关,其中MAP3K ZAK介导的应激反应(RSR)在细胞命运调控中起着关键作用。ZAK通过磷酸化下游的MAPKs(如p38和JNK)来启动一系列细胞应激反应,包括细胞周期停滞和细胞凋亡。

图1 在碰撞核糖体处引发的ZAK激活
尽管ZAK在细胞应激反应中扮演重要角色,但其与核糖体的相互作用机制及其如何被激活仍不完全清楚。近期的研究通过结合生化实验与冷冻电镜技术,揭示了ZAK与核糖体之间复杂的相互作用网络。这些相互作用不仅决定了ZAK在正常条件下的稳定结合,还决定了其在应激条件下的激活。研究发现,ZAK在核糖体上的结合和激活依赖于多个关键结构域和蛋白相互作用位点,其中RACK1是一个重要的支架蛋白,能够促进ZAK的激活。
ZAK的C端区域包含多个与核糖体结合的关键结构域,如与核糖体蛋白eS27和ES7的相互作用位点,这些结构域在未发生碰撞时就已经与核糖体结合,可能起到“采样”作用,即在未应激状态下,ZAK通过这些位点与核糖体的多个部分建立弱相互作用,以保持其在细胞内的分布。然而,当发生核糖体碰撞时,ZAK的结构域会重新排列,使其与RACK1的特定区域(如RIM和RIH)发生更紧密的结合,从而促进其SAM结构域的二聚化。这种SAM结构域的二聚化是ZAK激活的关键步骤,它可能通过结构上的改变促进其自身磷酸化,进而引发下游信号通路的激活。
研究还发现,ZAK的激活过程受到另一种核糖体结合蛋白SERBP1的负调控。SERBP1通过与RACK1的特定区域(FPxL motif)结合,与ZAK竞争RACK1的结合位点,从而防止ZAK在未发生碰撞时被激活。这一发现提示,SERBP1可能作为ZAK的天然抑制因子,确保ZAK仅在特定的应激条件下被激活,从而避免不必要的细胞损伤。
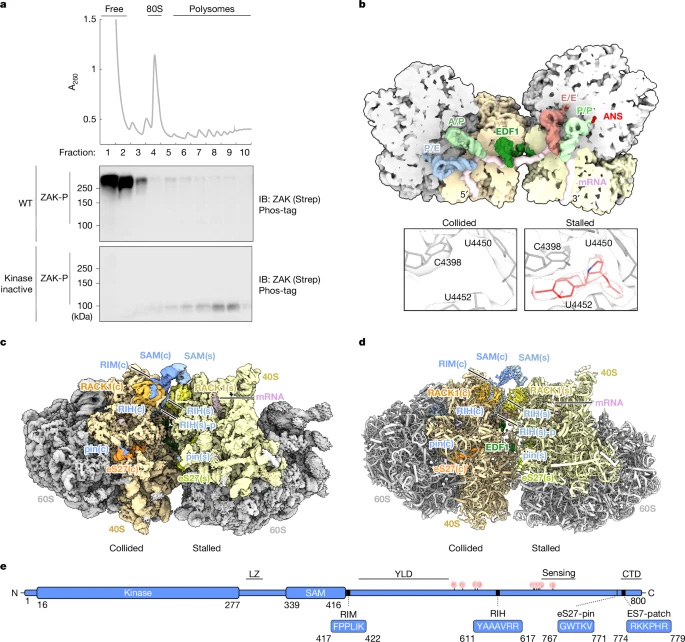
图2 ZAKα蛋白结合碰撞二聚体核糖体的冷冻电镜结构
此外,研究还揭示了ZAK的SAM结构域在核糖体碰撞后的关键作用。SAM结构域的二聚化不仅促进ZAK的激活,还可能影响其与其他信号分子(如14-3-3蛋白)的相互作用,这些蛋白在ZAK激活后会帮助其招募到下游效应器上,从而启动应激反应。ZAK的某些突变形式,如F368C和W347S,表现出超活性,能够在没有核糖体碰撞的情况下激活ZAK,这表明SAM结构域本身可能具有调控ZAK的活性和抑制功能。
研究中还通过不同实验方法验证了这些结构域和相互作用位点的功能。例如,通过免疫印迹和CLIP-seq分析,研究人员确认了ZAK在核糖体上的结合模式及其在碰撞后的激活状态。这些实验不仅揭示了ZAK与核糖体的相互作用,还进一步说明了SAM结构域的二聚化是ZAK激活的核心机制。
总体来看,这项研究为理解ZAK如何在核糖体碰撞后被激活提供了分子层面的蓝图。ZAK的激活过程涉及多个结构域的协同作用,包括C端的结合位点、RIH和RIM的碰撞特异性相互作用,以及SAM结构域的二聚化。这些相互作用共同构成了一个精密的调控网络,确保ZAK在合适的时机被激活,从而引发细胞的应激反应。同时,研究还揭示了SERBP1在抑制ZAK激活中的作用,这为理解细胞如何在正常条件下维持ZAK的非激活状态提供了重要线索。
此外,研究还探讨了ZAK的活性调控是否依赖于核糖体。通过引入不同的突变体,研究人员发现,某些SAM结构域的突变可以绕过核糖体碰撞,直接导致ZAK的激活。这表明,ZAK的活性调控可能不仅仅依赖于核糖体的物理碰撞,而是通过其结构域的相互作用来实现。这一发现为未来研究ZAK及其他SAM结构域蛋白的调控机制提供了新的视角。
综上所述,ZAK在细胞应激反应中的作用机制是复杂的,涉及多个结构域与核糖体及其相关蛋白的相互作用。这些相互作用不仅决定了ZAK在细胞内的分布和结合,还决定了其是否能够被激活。
参考资料
[1] ZAK activation at the collided ribosome
摘要:通过生化与冷冻电镜技术,揭示ZAK激酶在核糖体碰撞中的激活机制。
在细胞内,蛋白质合成是一个高度调控的过程,它不仅涉及遗传信息的准确传递,还与细胞的应激反应密切相关。当翻译过程中出现障碍时,例如mRNA的损伤或营养缺乏,细胞内的核糖体会暂时停滞,这种停滞会导致相邻的核糖体发生碰撞。这种核糖体碰撞不仅是细胞内质量控制机制的触发信号,还与广泛的应激信号通路相关,其中MAP3K ZAK介导的应激反应(RSR)在细胞命运调控中起着关键作用。ZAK通过磷酸化下游的MAPKs(如p38和JNK)来启动一系列细胞应激反应,包括细胞周期停滞和细胞凋亡。

图1 在碰撞核糖体处引发的ZAK激活
尽管ZAK在细胞应激反应中扮演重要角色,但其与核糖体的相互作用机制及其如何被激活仍不完全清楚。近期的研究通过结合生化实验与冷冻电镜技术,揭示了ZAK与核糖体之间复杂的相互作用网络。这些相互作用不仅决定了ZAK在正常条件下的稳定结合,还决定了其在应激条件下的激活。研究发现,ZAK在核糖体上的结合和激活依赖于多个关键结构域和蛋白相互作用位点,其中RACK1是一个重要的支架蛋白,能够促进ZAK的激活。
ZAK的C端区域包含多个与核糖体结合的关键结构域,如与核糖体蛋白eS27和ES7的相互作用位点,这些结构域在未发生碰撞时就已经与核糖体结合,可能起到“采样”作用,即在未应激状态下,ZAK通过这些位点与核糖体的多个部分建立弱相互作用,以保持其在细胞内的分布。然而,当发生核糖体碰撞时,ZAK的结构域会重新排列,使其与RACK1的特定区域(如RIM和RIH)发生更紧密的结合,从而促进其SAM结构域的二聚化。这种SAM结构域的二聚化是ZAK激活的关键步骤,它可能通过结构上的改变促进其自身磷酸化,进而引发下游信号通路的激活。
研究还发现,ZAK的激活过程受到另一种核糖体结合蛋白SERBP1的负调控。SERBP1通过与RACK1的特定区域(FPxL motif)结合,与ZAK竞争RACK1的结合位点,从而防止ZAK在未发生碰撞时被激活。这一发现提示,SERBP1可能作为ZAK的天然抑制因子,确保ZAK仅在特定的应激条件下被激活,从而避免不必要的细胞损伤。

图2 ZAKα蛋白结合碰撞二聚体核糖体的冷冻电镜结构
此外,研究还揭示了ZAK的SAM结构域在核糖体碰撞后的关键作用。SAM结构域的二聚化不仅促进ZAK的激活,还可能影响其与其他信号分子(如14-3-3蛋白)的相互作用,这些蛋白在ZAK激活后会帮助其招募到下游效应器上,从而启动应激反应。ZAK的某些突变形式,如F368C和W347S,表现出超活性,能够在没有核糖体碰撞的情况下激活ZAK,这表明SAM结构域本身可能具有调控ZAK的活性和抑制功能。
研究中还通过不同实验方法验证了这些结构域和相互作用位点的功能。例如,通过免疫印迹和CLIP-seq分析,研究人员确认了ZAK在核糖体上的结合模式及其在碰撞后的激活状态。这些实验不仅揭示了ZAK与核糖体的相互作用,还进一步说明了SAM结构域的二聚化是ZAK激活的核心机制。
总体来看,这项研究为理解ZAK如何在核糖体碰撞后被激活提供了分子层面的蓝图。ZAK的激活过程涉及多个结构域的协同作用,包括C端的结合位点、RIH和RIM的碰撞特异性相互作用,以及SAM结构域的二聚化。这些相互作用共同构成了一个精密的调控网络,确保ZAK在合适的时机被激活,从而引发细胞的应激反应。同时,研究还揭示了SERBP1在抑制ZAK激活中的作用,这为理解细胞如何在正常条件下维持ZAK的非激活状态提供了重要线索。
此外,研究还探讨了ZAK的活性调控是否依赖于核糖体。通过引入不同的突变体,研究人员发现,某些SAM结构域的突变可以绕过核糖体碰撞,直接导致ZAK的激活。这表明,ZAK的活性调控可能不仅仅依赖于核糖体的物理碰撞,而是通过其结构域的相互作用来实现。这一发现为未来研究ZAK及其他SAM结构域蛋白的调控机制提供了新的视角。
综上所述,ZAK在细胞应激反应中的作用机制是复杂的,涉及多个结构域与核糖体及其相关蛋白的相互作用。这些相互作用不仅决定了ZAK在细胞内的分布和结合,还决定了其是否能够被激活。
参考资料
[1] ZAK activation at the collided ribosome



