摘要:研究发现,肿瘤细胞分泌的LCN2通过SLC22A17/JAK2/STAT3通路激活星形胶质细胞,招募巨噬细胞。
肺癌是全球范围内发病率和死亡率最高的恶性肿瘤之一,而脑转移(Brain Metastasis, BM)是导致肺癌患者死亡的主要原因,发生率高达50%。尽管针对EGFR、ALK等驱动基因的靶向治疗以及免疫治疗和放疗取得了显著进展,但肺癌脑转移患者的预后仍然极差。脑部独特的微环境,包括星形胶质细胞、小胶质细胞、少突胶质细胞和神经元等,在脑转移的发生和发展中扮演着关键角色。然而,肿瘤细胞与脑部微环境细胞之间相互作用的分子机制尚不完全清楚,这限制了有效治疗策略的开发。
为了阐明肺癌脑转移的分子机制,来自中国医学科学院肿瘤医院等机构的研究团队在《Signal Transduction and Targeted Therapy》杂志上发表了一项重要研究。该研究通过整合单细胞RNA测序(scRNA-seq)、临床样本分析以及体内外功能实验,揭示了脂质运载蛋白-2(Lipocalin-2, LCN2)在驱动肺癌脑转移中的核心作用。研究发现,肿瘤细胞分泌的LCN2通过激活星形胶质细胞和招募巨噬细胞,形成了一个促进肿瘤生长的恶性循环,并同时通过自分泌方式促进肿瘤血管生成。该研究不仅阐明了LCN2在脑转移中的双重驱动机制,还提出了靶向LCN2轴的治疗新策略。

图1 脂质运载蛋白-2通过肺癌中肿瘤与微环境的相互作用驱动脑转移进展
关键技术方法
本研究综合运用了多种前沿技术手段。在临床样本分析方面,研究人员收集了肺癌脑转移患者的配对原发灶和脑转移灶组织、血浆样本以及单细胞RNA测序数据,并结合公共数据库(如GEO)进行生物信息学分析。在实验模型构建上,研究团队通过左心室注射、颈动脉注射和颅内原位注射等方法,成功建立了多种肺癌脑转移小鼠模型。在机制探索方面,研究采用了基因敲低(shRNA)和过表达技术、蛋白质印迹(Western Blot)、免疫共沉淀(Co-IP)、酶联免疫吸附试验(ELISA)、免疫荧光(IF)和免疫组化(IHC)等分子生物学技术,并利用体外血脑屏障(BBB)模型、细胞共培养体系以及血管生成实验,深入解析了LCN2在肿瘤-微环境互作中的功能。
研究结果
LCN2在肺癌脑转移中高表达并与不良预后相关
为了寻找驱动肺癌脑转移的关键基因,研究人员首先对配对的肺癌原发灶和脑转移灶组织进行了转录组学分析。结果发现,LCN2、NCAM1、S100B和SPP1这四个基因在脑转移灶中一致性上调。通过单细胞RNA测序分析,研究人员进一步确认,在这四个候选基因中,只有LCN2主要在肿瘤细胞中表达,并且在脑转移灶中的表达水平显著高于原发灶。这一发现在体外实验中也得到了验证,通过左心室注射构建的脑转移细胞株(PC9-BM)中,LCN2的表达水平远高于亲本细胞(PC9)及其他转移灶(如肺、肝)来源的细胞。临床样本分析显示,在43对配对的患者样本中,脑转移灶的LCN2蛋白水平显著高于原发灶。此外,高表达LCN2的脑转移患者,其颅内无病生存期(iDFS)显著缩短。血浆检测也发现,脑转移患者的LCN2水平显著高于健康对照和肝转移患者。这些数据共同表明,LCN2在肺癌脑转移中高表达,并与患者的不良预后密切相关。
LCN2促进脑转移灶的生长,但不影响血脑屏障的穿越
为了明确LCN2在脑转移过程中的功能,研究人员在多种肺癌细胞系中进行了LCN2的敲低和过表达操作。体外实验发现,LCN2的敲低或过表达并不影响肿瘤细胞的迁移能力,也不影响其穿越体外血脑屏障模型的能力。体内实验进一步证实,无论是通过左心室注射还是颈动脉注射,LCN2的敲低或过表达均不影响肿瘤细胞穿越血脑屏障进入脑实质。然而,一旦肿瘤细胞进入脑实质,LCN2的作用便显现出来。通过颅内原位注射实验,研究人员发现,敲低LCN2的PC9-BM细胞形成的脑内肿瘤负荷显著降低,而过表达LCN2的A549和TC1细胞则形成了更大的脑内肿瘤,并导致荷瘤小鼠的生存期缩短。这些结果表明,LCN2对于肿瘤细胞穿越血脑屏障并非必需,但对于肿瘤细胞在脑微环境中的定植和生长至关重要。
LCN2通过JAK2/STAT3通路促进脑转移灶的血管生成
为了探究LCN2促进脑转移生长的机制,研究人员对LCN2高表达和低表达的肿瘤细胞进行了基因富集分析(GO analysis)。结果显示,LCN2高表达的肿瘤细胞中,炎症反应和IL6-JAK-STAT3信号通路被显著激活。通过细胞因子芯片和ELISA检测,研究人员发现,LCN2高表达的肿瘤细胞分泌的血管内皮生长因子-A(VEGF-A)水平显著升高。进一步的机制研究表明,LCN2通过结合其受体SLC22A17,激活了肿瘤细胞内的JAK2/STAT3信号通路,从而上调了VEGF-A的表达和分泌。功能实验证实,LCN2高表达肿瘤细胞的条件培养基能够显著促进脑内皮细胞的成管能力,而体内实验也显示,LCN2高表达肿瘤形成的脑转移灶中,微血管密度显著增加。在治疗方面,STAT3抑制剂SH4-54和抗VEGF-A抗体贝伐珠单抗(bevacizumab)均能有效抑制LCN2高表达脑转移小鼠模型的肿瘤生长。这些结果揭示了LCN2通过激活肿瘤细胞自身的JAK2/STAT3通路,促进VEGF-A介导的血管生成,从而驱动脑转移灶的生长。
LCN2通过激活星形胶质细胞和招募巨噬细胞重塑脑转移微环境
研究人员发现,LCN2对肿瘤生长的促进作用具有脑部特异性,在皮下或肺原位肿瘤模型中,LCN2的敲低或过表达并不影响肿瘤的生长和血管密度。单细胞RNA测序分析显示,脑转移灶中富含神经胶质细胞,特别是星形胶质细胞和少突胶质细胞,而这两种细胞均高表达LCN2的受体SLC22A17。在LCN2高表达的脑转移灶中,巨噬细胞的浸润比例显著增加,而星形胶质细胞中与细胞因子-细胞因子受体相互作用相关的通路被富集,特别是巨噬细胞趋化因子CCL2的表达上调。临床样本的免疫组化分析也证实,LCN2蛋白水平与巨噬细胞标志物CD68的表达呈正相关。体外实验进一步证明,LCN2高表达的肿瘤细胞与星形胶质细胞共培养后,能够显著促进巨噬细胞的迁移,而这一效应依赖于星形胶质细胞分泌的CCL2。这些结果表明,LCN2通过激活星形胶质细胞,促进巨噬细胞的招募,从而重塑了脑转移微环境。
LCN2通过结合SLC22A17激活星形胶质细胞的JAK2/STAT3信号通路
为了阐明LCN2激活星形胶质细胞的分子机制,研究人员进行了免疫荧光和免疫共沉淀实验。结果发现,LCN2与星形胶质细胞表面的SLC22A17受体存在共定位和直接结合。进一步的机制研究表明,LCN2与SLC22A17的结合,激活了星形胶质细胞内的JAK2/STAT3信号通路,进而上调了CCL2的表达和分泌。使用LCN2中和抗体或敲低SLC22A17,均能显著抑制LCN2诱导的JAK2/STAT3磷酸化、CCL2分泌以及巨噬细胞的招募。这些结果揭示了LCN2通过结合星形胶质细胞表面的SLC22A17受体,激活JAK2/STAT3信号通路,从而诱导CCL2分泌和巨噬细胞招募的分子机制。
巨噬细胞通过IL-1β/IL-1R/NF-κB通路正反馈上调肿瘤细胞LCN2表达
为了探究脑转移灶中LCN2高表达的来源,研究人员发现,巨噬细胞是脑转移微环境中IL-1β的主要来源。体外实验证实,巨噬细胞分泌的IL-1β能够显著上调肿瘤细胞中LCN2的表达。机制研究表明,IL-1β通过与其受体IL-1R结合,激活了肿瘤细胞内的NF-κB信号通路,从而转录上调LCN2的表达。使用IL-1R拮抗剂阿那白滞素(anakinra)或NF-κB抑制剂,均能阻断巨噬细胞诱导的LCN2上调。这些结果揭示了一个正反馈循环:肿瘤细胞分泌的LCN2激活星形胶质细胞,招募巨噬细胞;巨噬细胞分泌的IL-1β又反过来进一步上调肿瘤细胞的LCN2表达,从而形成了一个促进脑转移进展的恶性循环。
靶向IL-1β/IL-1R轴可抑制脑转移的形成
为了评估靶向IL-1β/IL-1R轴的治疗潜力,研究人员在小鼠模型中进行了预防性和治疗性研究。结果显示,在脑转移形成前预防性给予阿那白滞素,能够显著抑制脑转移灶的生长并延长小鼠的生存期。然而,在脑转移灶形成后进行治疗,阿那白滞素单药治疗无效。值得注意的是,STAT3抑制剂SH4-54单药治疗或与阿那白滞素联合治疗,均能有效抑制已建立的脑转移灶的生长。这些结果表明,早期干预IL-1β/IL-1R轴可以预防脑转移的发生,而对于已形成的脑转移灶,可能需要联合靶向STAT3等其他通路才能取得更好的治疗效果。
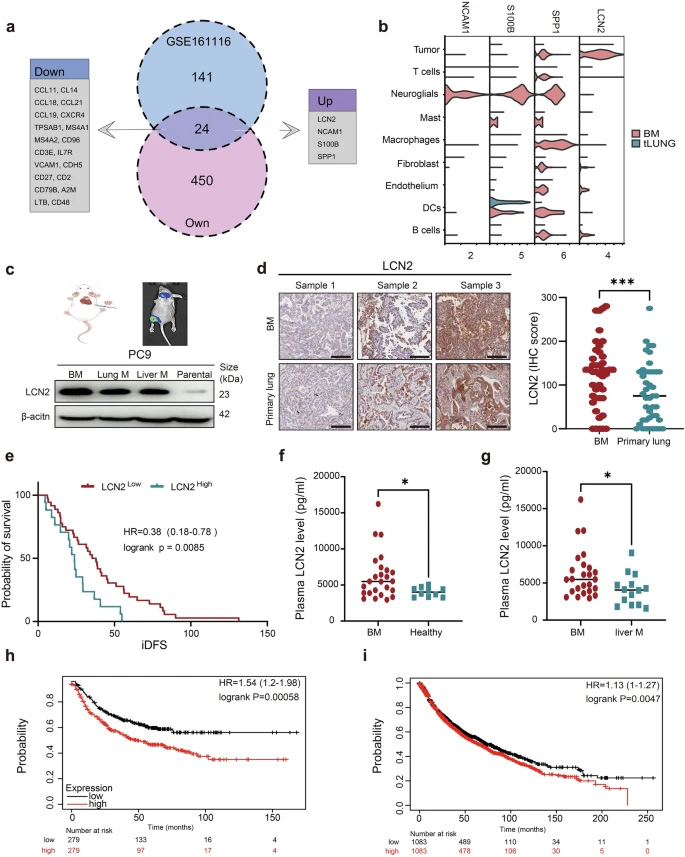
图2 LCN2在脑转移组织中过表达,且与肺癌患者的不良预后相关
研究结论与讨论
本研究系统性地揭示了LCN2在肺癌脑转移中的核心作用。研究发现,LCN2通过一个复杂的肿瘤-微环境互作网络,驱动脑转移的进展。一方面,肿瘤细胞分泌的LCN2通过旁分泌方式,结合星形胶质细胞表面的SLC22A17受体,激活JAK2/STAT3信号通路,诱导CCL2等趋化因子的分泌,从而招募巨噬细胞。被招募的巨噬细胞分泌IL-1β,通过IL-1R/NF-κB信号通路,正反馈上调肿瘤细胞的LCN2表达,形成了一个促进肿瘤生长的恶性循环。另一方面,LCN2还通过自分泌方式,结合肿瘤细胞自身的SLC22A17受体,激活JAK2/STAT3信号通路,上调VEGF-A的表达,促进肿瘤血管生成,为肿瘤的生长提供营养支持。
该研究不仅阐明了LCN2在脑转移中的双重驱动机制,还提出了具有转化潜力的治疗策略。研究证明,预防性抑制IL-1β/IL-1R轴可以打破恶性循环,抑制脑转移的形成。对于已形成的脑转移灶,靶向STAT3或VEGF-A通路能够有效抑制肿瘤生长。这些发现为开发针对肺癌脑转移的新疗法提供了重要的理论依据和实验证据。LCN2不仅是一个关键的驱动因子,也可能作为预测STAT3靶向治疗疗效的生物标志物。未来,开发能够高效穿越血脑屏障的LCN2靶向药物,或联合靶向LCN2轴上的多个节点,有望为肺癌脑转移患者带来新的希望。
参考资料
[1] Lipocalin-2 drives brain metastatic progression through reciprocal tumor-microenvironment interactions in lung cancer
摘要:研究发现,肿瘤细胞分泌的LCN2通过SLC22A17/JAK2/STAT3通路激活星形胶质细胞,招募巨噬细胞。
肺癌是全球范围内发病率和死亡率最高的恶性肿瘤之一,而脑转移(Brain Metastasis, BM)是导致肺癌患者死亡的主要原因,发生率高达50%。尽管针对EGFR、ALK等驱动基因的靶向治疗以及免疫治疗和放疗取得了显著进展,但肺癌脑转移患者的预后仍然极差。脑部独特的微环境,包括星形胶质细胞、小胶质细胞、少突胶质细胞和神经元等,在脑转移的发生和发展中扮演着关键角色。然而,肿瘤细胞与脑部微环境细胞之间相互作用的分子机制尚不完全清楚,这限制了有效治疗策略的开发。
为了阐明肺癌脑转移的分子机制,来自中国医学科学院肿瘤医院等机构的研究团队在《Signal Transduction and Targeted Therapy》杂志上发表了一项重要研究。该研究通过整合单细胞RNA测序(scRNA-seq)、临床样本分析以及体内外功能实验,揭示了脂质运载蛋白-2(Lipocalin-2, LCN2)在驱动肺癌脑转移中的核心作用。研究发现,肿瘤细胞分泌的LCN2通过激活星形胶质细胞和招募巨噬细胞,形成了一个促进肿瘤生长的恶性循环,并同时通过自分泌方式促进肿瘤血管生成。该研究不仅阐明了LCN2在脑转移中的双重驱动机制,还提出了靶向LCN2轴的治疗新策略。

图1 脂质运载蛋白-2通过肺癌中肿瘤与微环境的相互作用驱动脑转移进展
关键技术方法
本研究综合运用了多种前沿技术手段。在临床样本分析方面,研究人员收集了肺癌脑转移患者的配对原发灶和脑转移灶组织、血浆样本以及单细胞RNA测序数据,并结合公共数据库(如GEO)进行生物信息学分析。在实验模型构建上,研究团队通过左心室注射、颈动脉注射和颅内原位注射等方法,成功建立了多种肺癌脑转移小鼠模型。在机制探索方面,研究采用了基因敲低(shRNA)和过表达技术、蛋白质印迹(Western Blot)、免疫共沉淀(Co-IP)、酶联免疫吸附试验(ELISA)、免疫荧光(IF)和免疫组化(IHC)等分子生物学技术,并利用体外血脑屏障(BBB)模型、细胞共培养体系以及血管生成实验,深入解析了LCN2在肿瘤-微环境互作中的功能。
研究结果
LCN2在肺癌脑转移中高表达并与不良预后相关
为了寻找驱动肺癌脑转移的关键基因,研究人员首先对配对的肺癌原发灶和脑转移灶组织进行了转录组学分析。结果发现,LCN2、NCAM1、S100B和SPP1这四个基因在脑转移灶中一致性上调。通过单细胞RNA测序分析,研究人员进一步确认,在这四个候选基因中,只有LCN2主要在肿瘤细胞中表达,并且在脑转移灶中的表达水平显著高于原发灶。这一发现在体外实验中也得到了验证,通过左心室注射构建的脑转移细胞株(PC9-BM)中,LCN2的表达水平远高于亲本细胞(PC9)及其他转移灶(如肺、肝)来源的细胞。临床样本分析显示,在43对配对的患者样本中,脑转移灶的LCN2蛋白水平显著高于原发灶。此外,高表达LCN2的脑转移患者,其颅内无病生存期(iDFS)显著缩短。血浆检测也发现,脑转移患者的LCN2水平显著高于健康对照和肝转移患者。这些数据共同表明,LCN2在肺癌脑转移中高表达,并与患者的不良预后密切相关。
LCN2促进脑转移灶的生长,但不影响血脑屏障的穿越
为了明确LCN2在脑转移过程中的功能,研究人员在多种肺癌细胞系中进行了LCN2的敲低和过表达操作。体外实验发现,LCN2的敲低或过表达并不影响肿瘤细胞的迁移能力,也不影响其穿越体外血脑屏障模型的能力。体内实验进一步证实,无论是通过左心室注射还是颈动脉注射,LCN2的敲低或过表达均不影响肿瘤细胞穿越血脑屏障进入脑实质。然而,一旦肿瘤细胞进入脑实质,LCN2的作用便显现出来。通过颅内原位注射实验,研究人员发现,敲低LCN2的PC9-BM细胞形成的脑内肿瘤负荷显著降低,而过表达LCN2的A549和TC1细胞则形成了更大的脑内肿瘤,并导致荷瘤小鼠的生存期缩短。这些结果表明,LCN2对于肿瘤细胞穿越血脑屏障并非必需,但对于肿瘤细胞在脑微环境中的定植和生长至关重要。
LCN2通过JAK2/STAT3通路促进脑转移灶的血管生成
为了探究LCN2促进脑转移生长的机制,研究人员对LCN2高表达和低表达的肿瘤细胞进行了基因富集分析(GO analysis)。结果显示,LCN2高表达的肿瘤细胞中,炎症反应和IL6-JAK-STAT3信号通路被显著激活。通过细胞因子芯片和ELISA检测,研究人员发现,LCN2高表达的肿瘤细胞分泌的血管内皮生长因子-A(VEGF-A)水平显著升高。进一步的机制研究表明,LCN2通过结合其受体SLC22A17,激活了肿瘤细胞内的JAK2/STAT3信号通路,从而上调了VEGF-A的表达和分泌。功能实验证实,LCN2高表达肿瘤细胞的条件培养基能够显著促进脑内皮细胞的成管能力,而体内实验也显示,LCN2高表达肿瘤形成的脑转移灶中,微血管密度显著增加。在治疗方面,STAT3抑制剂SH4-54和抗VEGF-A抗体贝伐珠单抗(bevacizumab)均能有效抑制LCN2高表达脑转移小鼠模型的肿瘤生长。这些结果揭示了LCN2通过激活肿瘤细胞自身的JAK2/STAT3通路,促进VEGF-A介导的血管生成,从而驱动脑转移灶的生长。
LCN2通过激活星形胶质细胞和招募巨噬细胞重塑脑转移微环境
研究人员发现,LCN2对肿瘤生长的促进作用具有脑部特异性,在皮下或肺原位肿瘤模型中,LCN2的敲低或过表达并不影响肿瘤的生长和血管密度。单细胞RNA测序分析显示,脑转移灶中富含神经胶质细胞,特别是星形胶质细胞和少突胶质细胞,而这两种细胞均高表达LCN2的受体SLC22A17。在LCN2高表达的脑转移灶中,巨噬细胞的浸润比例显著增加,而星形胶质细胞中与细胞因子-细胞因子受体相互作用相关的通路被富集,特别是巨噬细胞趋化因子CCL2的表达上调。临床样本的免疫组化分析也证实,LCN2蛋白水平与巨噬细胞标志物CD68的表达呈正相关。体外实验进一步证明,LCN2高表达的肿瘤细胞与星形胶质细胞共培养后,能够显著促进巨噬细胞的迁移,而这一效应依赖于星形胶质细胞分泌的CCL2。这些结果表明,LCN2通过激活星形胶质细胞,促进巨噬细胞的招募,从而重塑了脑转移微环境。
LCN2通过结合SLC22A17激活星形胶质细胞的JAK2/STAT3信号通路
为了阐明LCN2激活星形胶质细胞的分子机制,研究人员进行了免疫荧光和免疫共沉淀实验。结果发现,LCN2与星形胶质细胞表面的SLC22A17受体存在共定位和直接结合。进一步的机制研究表明,LCN2与SLC22A17的结合,激活了星形胶质细胞内的JAK2/STAT3信号通路,进而上调了CCL2的表达和分泌。使用LCN2中和抗体或敲低SLC22A17,均能显著抑制LCN2诱导的JAK2/STAT3磷酸化、CCL2分泌以及巨噬细胞的招募。这些结果揭示了LCN2通过结合星形胶质细胞表面的SLC22A17受体,激活JAK2/STAT3信号通路,从而诱导CCL2分泌和巨噬细胞招募的分子机制。
巨噬细胞通过IL-1β/IL-1R/NF-κB通路正反馈上调肿瘤细胞LCN2表达
为了探究脑转移灶中LCN2高表达的来源,研究人员发现,巨噬细胞是脑转移微环境中IL-1β的主要来源。体外实验证实,巨噬细胞分泌的IL-1β能够显著上调肿瘤细胞中LCN2的表达。机制研究表明,IL-1β通过与其受体IL-1R结合,激活了肿瘤细胞内的NF-κB信号通路,从而转录上调LCN2的表达。使用IL-1R拮抗剂阿那白滞素(anakinra)或NF-κB抑制剂,均能阻断巨噬细胞诱导的LCN2上调。这些结果揭示了一个正反馈循环:肿瘤细胞分泌的LCN2激活星形胶质细胞,招募巨噬细胞;巨噬细胞分泌的IL-1β又反过来进一步上调肿瘤细胞的LCN2表达,从而形成了一个促进脑转移进展的恶性循环。
靶向IL-1β/IL-1R轴可抑制脑转移的形成
为了评估靶向IL-1β/IL-1R轴的治疗潜力,研究人员在小鼠模型中进行了预防性和治疗性研究。结果显示,在脑转移形成前预防性给予阿那白滞素,能够显著抑制脑转移灶的生长并延长小鼠的生存期。然而,在脑转移灶形成后进行治疗,阿那白滞素单药治疗无效。值得注意的是,STAT3抑制剂SH4-54单药治疗或与阿那白滞素联合治疗,均能有效抑制已建立的脑转移灶的生长。这些结果表明,早期干预IL-1β/IL-1R轴可以预防脑转移的发生,而对于已形成的脑转移灶,可能需要联合靶向STAT3等其他通路才能取得更好的治疗效果。

图2 LCN2在脑转移组织中过表达,且与肺癌患者的不良预后相关
研究结论与讨论
本研究系统性地揭示了LCN2在肺癌脑转移中的核心作用。研究发现,LCN2通过一个复杂的肿瘤-微环境互作网络,驱动脑转移的进展。一方面,肿瘤细胞分泌的LCN2通过旁分泌方式,结合星形胶质细胞表面的SLC22A17受体,激活JAK2/STAT3信号通路,诱导CCL2等趋化因子的分泌,从而招募巨噬细胞。被招募的巨噬细胞分泌IL-1β,通过IL-1R/NF-κB信号通路,正反馈上调肿瘤细胞的LCN2表达,形成了一个促进肿瘤生长的恶性循环。另一方面,LCN2还通过自分泌方式,结合肿瘤细胞自身的SLC22A17受体,激活JAK2/STAT3信号通路,上调VEGF-A的表达,促进肿瘤血管生成,为肿瘤的生长提供营养支持。
该研究不仅阐明了LCN2在脑转移中的双重驱动机制,还提出了具有转化潜力的治疗策略。研究证明,预防性抑制IL-1β/IL-1R轴可以打破恶性循环,抑制脑转移的形成。对于已形成的脑转移灶,靶向STAT3或VEGF-A通路能够有效抑制肿瘤生长。这些发现为开发针对肺癌脑转移的新疗法提供了重要的理论依据和实验证据。LCN2不仅是一个关键的驱动因子,也可能作为预测STAT3靶向治疗疗效的生物标志物。未来,开发能够高效穿越血脑屏障的LCN2靶向药物,或联合靶向LCN2轴上的多个节点,有望为肺癌脑转移患者带来新的希望。
参考资料
[1] Lipocalin-2 drives brain metastatic progression through reciprocal tumor-microenvironment interactions in lung cancer



