摘要:本文揭示了肠道共生菌分段丝状细菌(SFB)通过抗原模拟机制增强程序性细胞死亡蛋白1(PD-1)阻断疗法抗肿瘤效果的核心机制。
SFB促进ICB介导的肿瘤控制
为探究肠道菌群如何影响免疫介导的肿瘤控制,研究者构建了合成新抗原模拟肿瘤模型。通过使B16-F10黑色素瘤细胞表达肠道共生菌SFB的免疫显性蛋白片段(B16-3340),并在定植SFB(SFB+)与无SFB(SFB?)的特定无病原体小鼠中进行实验。研究发现,仅在同时存在SFB定植且肿瘤表达SFB抗原(B16-3340)并接受抗PD-1抗体治疗的小鼠中,肿瘤生长被显著抑制,而对照肿瘤(B16-EV)或无SFB定植的小鼠则无此效果。存活小鼠对再次接种的相同肿瘤细胞产生排斥,表明SFB与ICB联合可诱导持久的记忆样保护。此外,在肿瘤植入后不同时间点给予SFB的治疗性定植实验表明,早期微生物抗原暴露与PD-1阻断的协同作用窗口期较窄。

图1 PARP抑制通过转录与代谢重编程促进CD8+中央记忆性T细胞扩增
SFB改变肿瘤T细胞特征
对肿瘤浸润淋巴细胞的分析显示,SFB定植显著提高了B16-3340肿瘤中CD8+T细胞与调节性T(Treg)细胞的比例,并增强了CD8+TILs的效应功能(产生IFN-γ、TNF和Gzm-B)。更重要的是,通过SFB-3340肽段-MHCII四聚体染色,在SFB+小鼠的B16-3340肿瘤中鉴定出大量SFB特异性的CD4+T细胞。这些细胞在肿瘤微环境中表现出TH1样表型(表达T-bet和IFN-γ),而与它们在肠道固有层中原本的TH17表型(表达RORγt和IL-17A)形成鲜明对比。
肠道与肿瘤共享T细胞克隆性
通过单细胞RNA测序和T细胞受体测序分析发现,SFB+小鼠的肠道固有层与B16-3340肿瘤中的CD4+T细胞存在广泛的克隆重叠。这表明在肠道被SFB激活的TH17细胞可以迁移到远端的抗原匹配肿瘤中。这些细胞在肿瘤内发生了转录组重编程,上调了与细胞迁移、趋化因子分泌、促炎细胞因子和细胞毒性功能相关的基因,从而重塑肿瘤微环境,促进抗肿瘤免疫。
肿瘤内SFB特异性T细胞曾表达IL-17A
利用IL-17A命运报告小鼠(Il17a-cre;ROSA-LSL-tdTomato)进行谱系追踪,证实肿瘤内大量的SFB特异性(四聚体阳性)CD4+T细胞确实来源于曾经表达过IL-17A的T细胞(即ex-TH17细胞)。过继转移实验进一步验证,从报告小鼠分离的初始SFB特异性T细胞,在输入SFB定植的宿主小鼠后,能够从肠道迁移到远端肿瘤,并在肿瘤内分化为产生IFN-γ的效应细胞。
IL-17A谱系细胞是肿瘤控制所必需的
通过条件性消融IL-17A+CD4+T细胞的模型(DTA-ONΔIL-17a小鼠),研究发现清除这些细胞后,SFB对PD-1阻断的增强效应完全消失,肿瘤内CD8+T细胞的效应功能也严重受损。这直接证明了肠道SFB诱导的IL-17A+TH17细胞及其衍生的细胞是发挥协同抗肿瘤作用的关键。
肝螺杆菌无法控制肿瘤生长
作为对比,研究还考察了另一种肠道细菌肝螺杆菌。尽管Hh也能在肠道诱导抗原特异性CD4+T细胞(主要为Treg表型),并且这些细胞也能迁移到表达Hh抗原的肿瘤中,但它们未能有效转化为促炎的TH1样效应细胞,因此无法增强PD-1阻断的疗效。这突出了不同菌株诱导的T细胞程序(促炎还是调节)对免疫治疗结局的决定性影响。
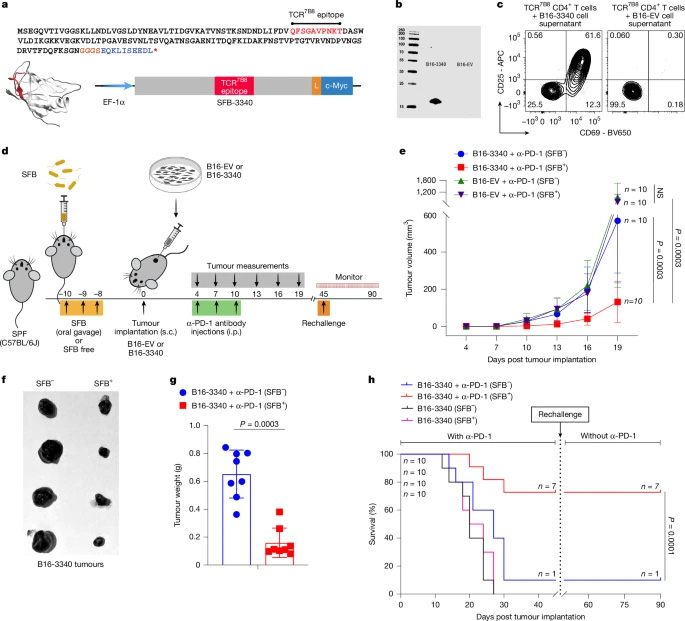
图2 开发一种基于合成菌群的肿瘤抗原模拟模型,用于评估对抗PD-1疗法的反应
讨论
本研究通过精巧的模型证实,单一的肠道共生菌SFB可通过抗原模拟机制,诱导肠道TH17细胞,这些细胞随后迁移至远端肿瘤并转化为具有强大抗肿瘤活性的TH1样效应细胞,从而显著增强PD-1阻断疗法的效果。该发现阐明了微生物群增强免疫检查点阻断疗效的一条具体细胞通路,即“肠道教育”的T细胞的可塑性及其在肿瘤微环境中的功能重塑,为开发基于微生物群的癌症免疫治疗新策略提供了重要的理论依据。
参考资料
[1] Microbiota-induced T cell plasticity enables immune-mediated tumour control
摘要:本文揭示了肠道共生菌分段丝状细菌(SFB)通过抗原模拟机制增强程序性细胞死亡蛋白1(PD-1)阻断疗法抗肿瘤效果的核心机制。
SFB促进ICB介导的肿瘤控制
为探究肠道菌群如何影响免疫介导的肿瘤控制,研究者构建了合成新抗原模拟肿瘤模型。通过使B16-F10黑色素瘤细胞表达肠道共生菌SFB的免疫显性蛋白片段(B16-3340),并在定植SFB(SFB+)与无SFB(SFB?)的特定无病原体小鼠中进行实验。研究发现,仅在同时存在SFB定植且肿瘤表达SFB抗原(B16-3340)并接受抗PD-1抗体治疗的小鼠中,肿瘤生长被显著抑制,而对照肿瘤(B16-EV)或无SFB定植的小鼠则无此效果。存活小鼠对再次接种的相同肿瘤细胞产生排斥,表明SFB与ICB联合可诱导持久的记忆样保护。此外,在肿瘤植入后不同时间点给予SFB的治疗性定植实验表明,早期微生物抗原暴露与PD-1阻断的协同作用窗口期较窄。

图1 PARP抑制通过转录与代谢重编程促进CD8+中央记忆性T细胞扩增
SFB改变肿瘤T细胞特征
对肿瘤浸润淋巴细胞的分析显示,SFB定植显著提高了B16-3340肿瘤中CD8+T细胞与调节性T(Treg)细胞的比例,并增强了CD8+TILs的效应功能(产生IFN-γ、TNF和Gzm-B)。更重要的是,通过SFB-3340肽段-MHCII四聚体染色,在SFB+小鼠的B16-3340肿瘤中鉴定出大量SFB特异性的CD4+T细胞。这些细胞在肿瘤微环境中表现出TH1样表型(表达T-bet和IFN-γ),而与它们在肠道固有层中原本的TH17表型(表达RORγt和IL-17A)形成鲜明对比。
肠道与肿瘤共享T细胞克隆性
通过单细胞RNA测序和T细胞受体测序分析发现,SFB+小鼠的肠道固有层与B16-3340肿瘤中的CD4+T细胞存在广泛的克隆重叠。这表明在肠道被SFB激活的TH17细胞可以迁移到远端的抗原匹配肿瘤中。这些细胞在肿瘤内发生了转录组重编程,上调了与细胞迁移、趋化因子分泌、促炎细胞因子和细胞毒性功能相关的基因,从而重塑肿瘤微环境,促进抗肿瘤免疫。
肿瘤内SFB特异性T细胞曾表达IL-17A
利用IL-17A命运报告小鼠(Il17a-cre;ROSA-LSL-tdTomato)进行谱系追踪,证实肿瘤内大量的SFB特异性(四聚体阳性)CD4+T细胞确实来源于曾经表达过IL-17A的T细胞(即ex-TH17细胞)。过继转移实验进一步验证,从报告小鼠分离的初始SFB特异性T细胞,在输入SFB定植的宿主小鼠后,能够从肠道迁移到远端肿瘤,并在肿瘤内分化为产生IFN-γ的效应细胞。
IL-17A谱系细胞是肿瘤控制所必需的
通过条件性消融IL-17A+CD4+T细胞的模型(DTA-ONΔIL-17a小鼠),研究发现清除这些细胞后,SFB对PD-1阻断的增强效应完全消失,肿瘤内CD8+T细胞的效应功能也严重受损。这直接证明了肠道SFB诱导的IL-17A+TH17细胞及其衍生的细胞是发挥协同抗肿瘤作用的关键。
肝螺杆菌无法控制肿瘤生长
作为对比,研究还考察了另一种肠道细菌肝螺杆菌。尽管Hh也能在肠道诱导抗原特异性CD4+T细胞(主要为Treg表型),并且这些细胞也能迁移到表达Hh抗原的肿瘤中,但它们未能有效转化为促炎的TH1样效应细胞,因此无法增强PD-1阻断的疗效。这突出了不同菌株诱导的T细胞程序(促炎还是调节)对免疫治疗结局的决定性影响。

图2 开发一种基于合成菌群的肿瘤抗原模拟模型,用于评估对抗PD-1疗法的反应
讨论
本研究通过精巧的模型证实,单一的肠道共生菌SFB可通过抗原模拟机制,诱导肠道TH17细胞,这些细胞随后迁移至远端肿瘤并转化为具有强大抗肿瘤活性的TH1样效应细胞,从而显著增强PD-1阻断疗法的效果。该发现阐明了微生物群增强免疫检查点阻断疗效的一条具体细胞通路,即“肠道教育”的T细胞的可塑性及其在肿瘤微环境中的功能重塑,为开发基于微生物群的癌症免疫治疗新策略提供了重要的理论依据。
参考资料
[1] Microbiota-induced T cell plasticity enables immune-mediated tumour control



