摘要:研究通过临床前模型及早期临床试验数据,证实Sevabertinib可有效抑制HER2信号通路。
SFB促进ICB介导的肿瘤控制
HER2(由ERBB2编码)的外显子20插入及其他激活突变在肺腺癌中发生率约为2%至4%,但目前针对这类患者的治疗选择有限。Sevabertinib(BAY 2927088)是一种强效、可逆的双重EGFR-HER2抑制剂,对野生型EGFR具有选择性。本研究报道了sevabertinib在携带HER2改变(包括外显子20插入、点突变和野生型ERBB2扩增)的肺癌模型中的临床前活性。此外,研究还证明了sevabertinib在一个依赖于神经调节蛋白-1(neuregulin-1, NRG1,HER2家族成员及其异二聚化伙伴HER3的配体)融合的癌细胞系中的活性。最后,文章报告了来自1/2期临床试验(NCT05099172)的患者对sevabertinib的反应数据,表明其对HER2突变肺癌患者具有潜在益处。
Sevabertinib是一种针对HER2外显子20插入的高效、选择性抑制剂
Sevabertinib被开发用于强效、可逆地抑制NSCLC中发现的HER2外显子20插入,相对于野生型EGFR具有高选择性,旨在降低毒性,并对其他HER2改变和突变EGFR具有额外选择性。虽然生化选择性在sevabertinib开发早期就已观察到,但其效力超过了现有生化检测方法的检测限。在生理相关ATP浓度下,sevabertinib对野生型HER2、HER2 A775insYVMA激酶结构域、野生型EGFR以及EGFR D770_N771insSVD激酶结构域的半数抑制浓度均低于0.5 nmol/L。Sevabertinib在生化测定中对HER4激酶结构域也有活性,但活性显著降低,对其他测试激酶亚群的活性进一步降低。由于生化测定灵敏度不足,在先导化合物优化过程中使用了细胞测定进行选择性分析,从而发现了sevabertinib。
利用EGFR与sevabertinib复合物的X射线晶体结构作为模板,构建了HER2的同源模型。所得三维结构突出了负责配体稳定的关键结构特征。铰链区Met801的主链NH通过向吡啶氮原子提供氢键将配体锚定在口袋中。内酰胺酰胺基团与DFG基序的Lys753和Asp863形成氢键。Lys753还与螺旋C的Glu770形成盐桥,这是整个激酶组中高度保守的相互作用,表明激酶结构域处于活性构象。苯胺游离的NH向Thr862侧链提供一个氢键,引导甲氧基氯苯基片段穿过守门员残基向疏水亚口袋延伸,而二氧六环环通过分子内氢键掩蔽游离的吡咯NH。与不可逆抑制剂不同,sevabertinib不与Cys805存在共价相互作用。这些与HER2的相互作用使sevabertinib成为一种高效的可逆结合剂。
使用KinaseProfiler平台评估了sevabertinib的脱靶效应。在该测定中,1 μmol/L sevabertinib抑制了373种测试激酶中的18种,活性抑制超过80%,包括三种EGFR激酶家族成员:EGFR、HER2和HER4。在含有2 mmol/L ATP的生化激酶活性测定中,最有效抑制的非ERBB家族激酶是DDR2,IC50值为53.3 nmol/L。这表明sevabertinib对野生型HER2的选择性比对DDR2高100倍以上,相对于其他测试的非ERBB家族激酶选择性更高。

图1 Sevabertinib:一种可用于肺癌治疗的可逆性HER2抑制剂
Sevabertinib在异位表达HER2外显子20插入或HER2点突变的同基因Ba/F3细胞中显示出强效抗增殖活性
使用通常依赖于白细胞介素-3存活和增殖的Ba/F3小鼠原B细胞系,生成了表达HER2外显子20插入或激活HER2点突变的同基因Ba/F3细胞 panel,这些突变消除了对添加IL3的需求。这些HER2依赖的Ba/F3细胞系以及类似的EGFR依赖的Ba/F3细胞系也被用于在化合物优化过程中测量抑制活性。
Sevabertinib强烈抑制异位表达HER2外显子20插入或野生型HER2的Ba/F3细胞系的增殖。Sevabertinib的抗增殖活性与不可逆HER2抑制剂zongertinib的活性相当,并且与测试的其他FDA批准的小分子HER2抑制剂的活性相当或更强,在这些细胞测定中相对于野生型EGFR具有约20倍的选择性。不可逆的EGFR/HER2外显子20插入抑制剂STX-721对最常见的HER2外显子20插入A775insYVMA显示出与sevabertinib相似的活性。除了外显子20插入,在HER2的激酶结构域、跨膜结构域和胞外域中还会发生复发的激活性和致癌性单核苷酸错义突变。Sevabertinib也能高效抑制表达这些HER2错义突变的Ba/F3细胞系的增殖,其活性再次优于测试的其他HER2抑制剂。
还研究了sevabertinib在表达HER2推定继发性获得性耐药突变T798M、T798I和C805S的同基因Ba/F3细胞系中的抗增殖活性,这些突变类似于EGFR的获得性耐药突变T790M和C797S。C805S突变完全阻断了不可逆HER2抑制剂的活性,而sevabertinib在顺式表达HER2外显子20插入突变或点突变与C805S的Ba/F3细胞系中仍保留活性。Sevabertinib对推定的次级HER2突变T798M也具有显著活性。这些结果表明,sevabertinib可能对患者中至少一些预测的HER2 TKI耐药突变具有活性。
Sevabertinib抑制内源性携带ERBB家族改变的癌细胞系的存活
为了评估sevabertinib在具有ERBB2外显子20插入以外的基因组改变的癌症适应症中的活性,使用PRISM测定进一步评估了sevabertinib在866个人类癌细胞系中的抗增殖效果。首先检查了sevabertinib反应与ERBB家族基因短发夹RNA敲低或CRISPR敲除敏感性之间的关系。与sevabertinib敏感性最相关的三个shRNA靶点是ERBB2、EGFR和ERBB3,与sevabertinib敏感性最相关的CRISPR靶点是ERBB2、MIEN1、GRHL2、EGFR、CAP1、STX4和ERBB3。然后重点分析了23个对sevabertinib反应最佳的癌细胞系。尽管PRISM筛选细胞系库中没有携带HER2外显子20插入的癌细胞系,但在几个具有ERBB2扩增的细胞系中观察到了对sevabertinib和zongertinib的强烈反应。sevabertinib敏感性与ERBB2 mRNA表达之间也存在强相关性。令人惊讶的是,在具有HER2点突变的细胞系中没有观察到显著反应。考虑到PRISM细胞系集中没有携带HER2外显子20插入的癌细胞系,发现一些ERBB2扩增的细胞系也对ERBB2敲除或敲低有反应。不出所料,在EGFR突变癌细胞系中,ERBB2敲除或敲低未见细胞存活率的显著降低。当综合考虑PRISM数据集中的所有细胞系时,再次发现一部分ERBB2扩增的癌细胞系对sevabertinib或zongertinib敏感,这部分细胞系与对ERBB2敲除或敲低有反应的ERBB2扩增癌细胞系有重叠。
内源性携带DOC4-NRG1融合的乳腺癌细胞系MDA-MB-175也对sevabertinib和zongertinib敏感。DOC4-NRG1融合导致NRG1(HER3的配体,HER3是HER2的异二聚化伙伴)组成性膜定位。在对sevabertinib最敏感的癌细胞系中,有三个携带EGFR外显子19缺失,这与表明sevabertinib对EGFR经典突变和外显子20插入也具有强效和选择性且不受C797S奥希替尼耐药突变影响的数据一致。虽然sevabertinib和zongertinib在具有不同HER2改变的癌细胞系中的活性通常相当,但zongertinib对经典和外显子20插入EGFR突变没有活性,因为zongertinib对HER2相对于EGFR具有选择性。
对于23个最敏感细胞系中的13个,未发现明显的反应基因组决定因素。虽然这13个剩余细胞系中的一个,BT-16细胞系,被发现携带MAK16和NRG1的基因组融合,但相对于NRG1编码序列在融合位点存在预测的移码,并且NRG1 EGF样结构域被排除。跨越推定融合断点的RNA测序读数数量较少,并且在抗NRG1免疫印迹上未检测到明显的非典型条带。因此,没有证据表明该MAK16-NRG1基因融合产生功能性融合蛋白。确实观察到在BT16细胞和另外两个缺乏已知致敏基因组改变的sevabertinib敏感细胞系TE617.T和DL中野生型NRG1表达升高。还观察到在DL细胞中NRG1受体HER3的表达和磷酸化,以及在BT-16和TE617.T细胞中HER4的表达和磷酸化。然而,这些特征与sevabertinib反应相关的生理相关性尚不完全清楚。
Sevabertinib在表达HER2外显子20插入或扩增野生型ERBB2的异种移植模型中显示出强大的抗肿瘤功效
在证实sevabertinib对HER2突变细胞具有强大抗增殖活性后,研究了sevabertinib在携带HER2外显子20插入的NSCLC异种移植模型中的抗肿瘤功效。在皮下CTG-2543患者来源异种移植模型中,与载体相比,每天一次给予10、25和50 mg/kg剂量的sevabertinib可抑制肿瘤生长并降低肿瘤重量。在携带HER2外显子20插入A775insV,G776C的NCI-H1781模型中,每天两次5 mg/kg或每天一次10 mg/kg剂量的sevabertinib在两个剂量下均显示出抗肿瘤功效。使用每天两次15 mg/kg或每天一次30 mg/kg剂量的zongertinib获得了类似的抗肿瘤反应。考虑到体外细胞数据表明sevabertinib对ERBB2扩增的癌症有影响,还测试了一个ERBB2扩增的异种移植模型。在携带野生型ERBB2扩增的NCI-N87模型中,每天两次给予2.5、5或10 mg/kg剂量的sevabertinib可抑制肿瘤生长,显示出与3 mg/kg T-DXd相当的强大体内抗肿瘤功效。在所有三个异种移植模型中,sevabertinib均被发现耐受性良好,表现为没有明显的体重减轻。
然后研究了sevabertinib对癌细胞系中HER2磷酸化和下游MAPK信号通路的抑制作用。用sevabertinib处理导致在携带HER2外显子20插入的NCI-H1781肺癌细胞、携带NRG1融合的MDA-MB-175-VII乳腺癌细胞、携带野生型ERBB2扩增的NCI-H2170肺癌细胞和携带野生型ERBB2扩增的NCI-N87胃癌细胞中磷酸化HER2、磷酸化MEK和磷酸化ERK水平降低。这些数据表明sevabertinib抑制了HER2-MAPK通路信号,在这些HER2依赖性细胞系中磷酸化AKT、磷酸化MEK和磷酸化ERK水平的剂量依赖性降低证明了这一点。HER3是一种ERBB家族蛋白,没有内在激酶活性,但可被HER2磷酸化,其在MDA-MB-175-VII和NCI-N87细胞中的磷酸化也被sevabertinib抑制。
具有HER2改变的细胞系未表达可检测水平的EGFR蛋白;NCI-2170和NCI-N87磷酸化EGFR免疫印迹中的磷酸化条带可能是由于磷酸化EGFR抗体与磷酸化HER2的交叉反应所致,磷酸化HER2更大,在SDS-PAGE中迁移较慢。仅在过表达野生型EGFR的A431细胞中,在最高浓度的sevabertinib下观察到对磷酸化EGFR、磷酸化MEK或磷酸化ERK的抑制,这与sevabertinib对野生型EGFR活性降低一致。
由于观察到一部分携带ERBB2扩增的癌细胞系对sevabertinib有反应,分析了乳腺癌和胃食管癌细胞系(两者均以复发性ERBB2扩增为特征)的反应与ERBB2扩增之间的相关性。乳腺癌和胃食管癌细胞系对sevabertinib的反应与存在高水平、局灶性ERBB2扩增相关,并且在携带野生型ERBB2扩增的胃癌细胞系NCI-N87中,sevabertinib有效抑制了HER2和下游信号蛋白的磷酸化。这些结果表明sevabertinib在携带ERBB2扩增的癌症患者中也可能具有活性。
Sevabertinib在两名HER2外显子20插入突变NSCLC患者中显示出抗肿瘤活性
在一项针对携带HER2突变的晚期NSCLC患者的sevabertinib首次人体研究中观察到了有希望的临床活性。此处介绍了两名携带HER2外显子20插入突变NSCLC患者接受每天两次20 mg sevabertinib治疗的病例研究。
一名51岁女性患者在进入试验前接受了两种全身治疗:一线培美曲塞和卡铂治疗4个月,二线多西他赛治疗2个月。该患者在接受sevabertinib治疗6、18和30周后分别达到41%、52%和53%的肿瘤缩小,达到部分缓解。尽管存在非靶病灶脑转移且在治疗前30周内保持稳定,但研究治疗30周后脑转移灶增大导致疾病进展。该患者总共接受了10个周期治疗,共219天,未进行永久性剂量降低。
一名55岁男性患者接受培美曲塞和卡铂作为一线治疗约6个月。进入试验后,该患者在治疗6周和54周后分别达到54%和78%的肿瘤缩小,达到部分缓解,直至治疗80周后发生疾病进展。该患者总共接受了28个周期治疗,共602天,未进行永久性剂量降低。该患者未观察到脑转移。
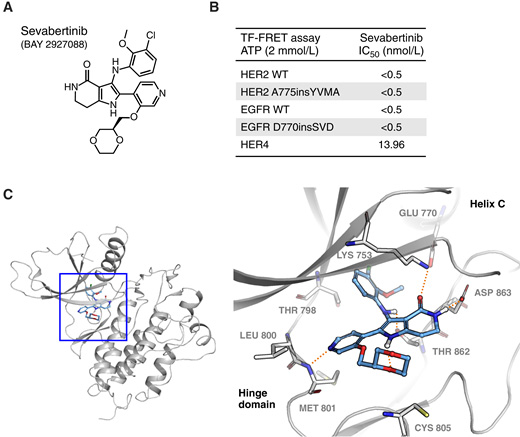
图2 sevabertinib是一种针对HER2外显子20插入突变的高效选择性抑制剂
讨论
目前,携带HER2外显子20插入的肺癌患者预后差,靶向治疗选择有限。尽管T-DXd和zongertinib已获得加速批准用于治疗携带HER2外显子20插入的NSCLC患者,但仍需要为这些患者提供有效且耐受性良好的口服疗法。重要的是,针对HER2外显子20插入NSCLC患者的疗法必须对相关的EGFR酪氨酸激酶受体活性降低,以最大限度地减少EGFR驱动的毒性。Sevabertinib是一种口服、可逆的HER2外显子20插入抑制剂,在同基因Ba/F3细胞测定中相对于野生型EGFR具有约20倍的选择性。在Ba/F3和癌细胞系存活测定、检查信号蛋白磷酸化的癌细胞系机制测定以及使用HER2 A775insYVMA PDX模型和细胞系来源异种移植模型的体内实验中证明了sevabertinib的活性和选择性。还提供了数据证明在参加1/2期试验的两名肺癌患者中sevabertinib具有抗肿瘤活性,导致两次部分缓解。
除了肺癌中的HER2外显子20插入,还观察到sevabertinib对一部分ERBB2扩增的乳腺癌、胃癌和食管癌细胞系具有活性。这一发现暗示sevabertinib在这些癌症患者中也可能具有活性,但需要注意的是,由于肿瘤异质性和共存突变,预计胃食管癌对HER2靶向药物的反应有限。还在同基因Ba/F3系统中观察到sevabertinib对HER2激活点和致癌点突变的活性,但有趣的是,未鉴定出内源性携带类似一组激活HER2点突变的敏感癌细胞系。这意味着具有内源性HER2错义突变的癌细胞系可能具有其他支持癌细胞存活和增殖而不依赖于突变HER2活性的致癌改变,或者可能具有掩盖HER2失活影响的生长特性。相反,确实观察到sevabertinib对内源性携带NRG1致癌易位的乳腺癌细胞系具有活性,这表明sevabertinib在这些罕见患者中也可能显示活性。Sevabertinib对具有经典激活突变和EGFR外显子20插入的癌细胞系也具有活性。最后,在23个对sevabertinib最敏感的细胞系中的13个中未检测到相关的基因组改变,这引发了关于这13个细胞系为何对sevabertinib敏感的问题。表观遗传改变可能是导致敏感性的原因,但需要进一步研究来解决这个问题。
除了sevabertinib,zongertinib也正在临床研究中评估其对携带HER2突变的肺癌患者的疗效。两种分子在具有ERBB改变的癌细胞系中具有相似的临床前功效。这两种抑制剂之间的主要区别在于sevabertinib是可逆的,而zongertinib是不可逆的,共价修饰HER2中的C805。因此,C805的突变将消除zongertinib的活性,而sevabertinib不受C805突变的影响。zongertinib的第一个1期临床数据现已报道,在携带HER2酪氨酸激酶结构域突变的NSCLC患者中,客观缓解率高达71%。有趣的是,在HER2突变位于酪氨酸激酶结构域之外的NSCLC患者中也观察到了一些反应。由于EGFR抑制和HER2抑制的毒性特征被认为部分重叠,因此很难预测sevabertinib和zongertinib的安全性特征是否存在差异,因为两者都抑制野生型HER2。Sevabertinib和zongertinib均处于3期临床试验阶段;它们之间的进一步区分有待这些临床试验结果。
总之,已经在携带HER2外显子20插入的NSCLC的细胞和体内模型中证明了sevabertinib的临床前活性。这种活性扩展到一部分携带ERBB2局灶扩增的癌细胞系。进一步提供了两名携带HER2外显子20插入的肺癌患者对sevabertinib产生反应的证据。针对携带HER2突变的NSCLC患者的sevabertinib 1期试验正在进行中。Sevabertinib在NSCLC中的3期试验和针对HER2突变实体瘤的2期开放性篮子试验现已开始招募患者。
参考资料
[1] Sevabertinib, a Reversible HER2 Inhibitor with Activity in Lung Cancer
摘要:研究通过临床前模型及早期临床试验数据,证实Sevabertinib可有效抑制HER2信号通路。
SFB促进ICB介导的肿瘤控制
HER2(由ERBB2编码)的外显子20插入及其他激活突变在肺腺癌中发生率约为2%至4%,但目前针对这类患者的治疗选择有限。Sevabertinib(BAY 2927088)是一种强效、可逆的双重EGFR-HER2抑制剂,对野生型EGFR具有选择性。本研究报道了sevabertinib在携带HER2改变(包括外显子20插入、点突变和野生型ERBB2扩增)的肺癌模型中的临床前活性。此外,研究还证明了sevabertinib在一个依赖于神经调节蛋白-1(neuregulin-1, NRG1,HER2家族成员及其异二聚化伙伴HER3的配体)融合的癌细胞系中的活性。最后,文章报告了来自1/2期临床试验(NCT05099172)的患者对sevabertinib的反应数据,表明其对HER2突变肺癌患者具有潜在益处。
Sevabertinib是一种针对HER2外显子20插入的高效、选择性抑制剂
Sevabertinib被开发用于强效、可逆地抑制NSCLC中发现的HER2外显子20插入,相对于野生型EGFR具有高选择性,旨在降低毒性,并对其他HER2改变和突变EGFR具有额外选择性。虽然生化选择性在sevabertinib开发早期就已观察到,但其效力超过了现有生化检测方法的检测限。在生理相关ATP浓度下,sevabertinib对野生型HER2、HER2 A775insYVMA激酶结构域、野生型EGFR以及EGFR D770_N771insSVD激酶结构域的半数抑制浓度均低于0.5 nmol/L。Sevabertinib在生化测定中对HER4激酶结构域也有活性,但活性显著降低,对其他测试激酶亚群的活性进一步降低。由于生化测定灵敏度不足,在先导化合物优化过程中使用了细胞测定进行选择性分析,从而发现了sevabertinib。
利用EGFR与sevabertinib复合物的X射线晶体结构作为模板,构建了HER2的同源模型。所得三维结构突出了负责配体稳定的关键结构特征。铰链区Met801的主链NH通过向吡啶氮原子提供氢键将配体锚定在口袋中。内酰胺酰胺基团与DFG基序的Lys753和Asp863形成氢键。Lys753还与螺旋C的Glu770形成盐桥,这是整个激酶组中高度保守的相互作用,表明激酶结构域处于活性构象。苯胺游离的NH向Thr862侧链提供一个氢键,引导甲氧基氯苯基片段穿过守门员残基向疏水亚口袋延伸,而二氧六环环通过分子内氢键掩蔽游离的吡咯NH。与不可逆抑制剂不同,sevabertinib不与Cys805存在共价相互作用。这些与HER2的相互作用使sevabertinib成为一种高效的可逆结合剂。
使用KinaseProfiler平台评估了sevabertinib的脱靶效应。在该测定中,1 μmol/L sevabertinib抑制了373种测试激酶中的18种,活性抑制超过80%,包括三种EGFR激酶家族成员:EGFR、HER2和HER4。在含有2 mmol/L ATP的生化激酶活性测定中,最有效抑制的非ERBB家族激酶是DDR2,IC50值为53.3 nmol/L。这表明sevabertinib对野生型HER2的选择性比对DDR2高100倍以上,相对于其他测试的非ERBB家族激酶选择性更高。

图1 Sevabertinib:一种可用于肺癌治疗的可逆性HER2抑制剂
Sevabertinib在异位表达HER2外显子20插入或HER2点突变的同基因Ba/F3细胞中显示出强效抗增殖活性
使用通常依赖于白细胞介素-3存活和增殖的Ba/F3小鼠原B细胞系,生成了表达HER2外显子20插入或激活HER2点突变的同基因Ba/F3细胞 panel,这些突变消除了对添加IL3的需求。这些HER2依赖的Ba/F3细胞系以及类似的EGFR依赖的Ba/F3细胞系也被用于在化合物优化过程中测量抑制活性。
Sevabertinib强烈抑制异位表达HER2外显子20插入或野生型HER2的Ba/F3细胞系的增殖。Sevabertinib的抗增殖活性与不可逆HER2抑制剂zongertinib的活性相当,并且与测试的其他FDA批准的小分子HER2抑制剂的活性相当或更强,在这些细胞测定中相对于野生型EGFR具有约20倍的选择性。不可逆的EGFR/HER2外显子20插入抑制剂STX-721对最常见的HER2外显子20插入A775insYVMA显示出与sevabertinib相似的活性。除了外显子20插入,在HER2的激酶结构域、跨膜结构域和胞外域中还会发生复发的激活性和致癌性单核苷酸错义突变。Sevabertinib也能高效抑制表达这些HER2错义突变的Ba/F3细胞系的增殖,其活性再次优于测试的其他HER2抑制剂。
还研究了sevabertinib在表达HER2推定继发性获得性耐药突变T798M、T798I和C805S的同基因Ba/F3细胞系中的抗增殖活性,这些突变类似于EGFR的获得性耐药突变T790M和C797S。C805S突变完全阻断了不可逆HER2抑制剂的活性,而sevabertinib在顺式表达HER2外显子20插入突变或点突变与C805S的Ba/F3细胞系中仍保留活性。Sevabertinib对推定的次级HER2突变T798M也具有显著活性。这些结果表明,sevabertinib可能对患者中至少一些预测的HER2 TKI耐药突变具有活性。
Sevabertinib抑制内源性携带ERBB家族改变的癌细胞系的存活
为了评估sevabertinib在具有ERBB2外显子20插入以外的基因组改变的癌症适应症中的活性,使用PRISM测定进一步评估了sevabertinib在866个人类癌细胞系中的抗增殖效果。首先检查了sevabertinib反应与ERBB家族基因短发夹RNA敲低或CRISPR敲除敏感性之间的关系。与sevabertinib敏感性最相关的三个shRNA靶点是ERBB2、EGFR和ERBB3,与sevabertinib敏感性最相关的CRISPR靶点是ERBB2、MIEN1、GRHL2、EGFR、CAP1、STX4和ERBB3。然后重点分析了23个对sevabertinib反应最佳的癌细胞系。尽管PRISM筛选细胞系库中没有携带HER2外显子20插入的癌细胞系,但在几个具有ERBB2扩增的细胞系中观察到了对sevabertinib和zongertinib的强烈反应。sevabertinib敏感性与ERBB2 mRNA表达之间也存在强相关性。令人惊讶的是,在具有HER2点突变的细胞系中没有观察到显著反应。考虑到PRISM细胞系集中没有携带HER2外显子20插入的癌细胞系,发现一些ERBB2扩增的细胞系也对ERBB2敲除或敲低有反应。不出所料,在EGFR突变癌细胞系中,ERBB2敲除或敲低未见细胞存活率的显著降低。当综合考虑PRISM数据集中的所有细胞系时,再次发现一部分ERBB2扩增的癌细胞系对sevabertinib或zongertinib敏感,这部分细胞系与对ERBB2敲除或敲低有反应的ERBB2扩增癌细胞系有重叠。
内源性携带DOC4-NRG1融合的乳腺癌细胞系MDA-MB-175也对sevabertinib和zongertinib敏感。DOC4-NRG1融合导致NRG1(HER3的配体,HER3是HER2的异二聚化伙伴)组成性膜定位。在对sevabertinib最敏感的癌细胞系中,有三个携带EGFR外显子19缺失,这与表明sevabertinib对EGFR经典突变和外显子20插入也具有强效和选择性且不受C797S奥希替尼耐药突变影响的数据一致。虽然sevabertinib和zongertinib在具有不同HER2改变的癌细胞系中的活性通常相当,但zongertinib对经典和外显子20插入EGFR突变没有活性,因为zongertinib对HER2相对于EGFR具有选择性。
对于23个最敏感细胞系中的13个,未发现明显的反应基因组决定因素。虽然这13个剩余细胞系中的一个,BT-16细胞系,被发现携带MAK16和NRG1的基因组融合,但相对于NRG1编码序列在融合位点存在预测的移码,并且NRG1 EGF样结构域被排除。跨越推定融合断点的RNA测序读数数量较少,并且在抗NRG1免疫印迹上未检测到明显的非典型条带。因此,没有证据表明该MAK16-NRG1基因融合产生功能性融合蛋白。确实观察到在BT16细胞和另外两个缺乏已知致敏基因组改变的sevabertinib敏感细胞系TE617.T和DL中野生型NRG1表达升高。还观察到在DL细胞中NRG1受体HER3的表达和磷酸化,以及在BT-16和TE617.T细胞中HER4的表达和磷酸化。然而,这些特征与sevabertinib反应相关的生理相关性尚不完全清楚。
Sevabertinib在表达HER2外显子20插入或扩增野生型ERBB2的异种移植模型中显示出强大的抗肿瘤功效
在证实sevabertinib对HER2突变细胞具有强大抗增殖活性后,研究了sevabertinib在携带HER2外显子20插入的NSCLC异种移植模型中的抗肿瘤功效。在皮下CTG-2543患者来源异种移植模型中,与载体相比,每天一次给予10、25和50 mg/kg剂量的sevabertinib可抑制肿瘤生长并降低肿瘤重量。在携带HER2外显子20插入A775insV,G776C的NCI-H1781模型中,每天两次5 mg/kg或每天一次10 mg/kg剂量的sevabertinib在两个剂量下均显示出抗肿瘤功效。使用每天两次15 mg/kg或每天一次30 mg/kg剂量的zongertinib获得了类似的抗肿瘤反应。考虑到体外细胞数据表明sevabertinib对ERBB2扩增的癌症有影响,还测试了一个ERBB2扩增的异种移植模型。在携带野生型ERBB2扩增的NCI-N87模型中,每天两次给予2.5、5或10 mg/kg剂量的sevabertinib可抑制肿瘤生长,显示出与3 mg/kg T-DXd相当的强大体内抗肿瘤功效。在所有三个异种移植模型中,sevabertinib均被发现耐受性良好,表现为没有明显的体重减轻。
然后研究了sevabertinib对癌细胞系中HER2磷酸化和下游MAPK信号通路的抑制作用。用sevabertinib处理导致在携带HER2外显子20插入的NCI-H1781肺癌细胞、携带NRG1融合的MDA-MB-175-VII乳腺癌细胞、携带野生型ERBB2扩增的NCI-H2170肺癌细胞和携带野生型ERBB2扩增的NCI-N87胃癌细胞中磷酸化HER2、磷酸化MEK和磷酸化ERK水平降低。这些数据表明sevabertinib抑制了HER2-MAPK通路信号,在这些HER2依赖性细胞系中磷酸化AKT、磷酸化MEK和磷酸化ERK水平的剂量依赖性降低证明了这一点。HER3是一种ERBB家族蛋白,没有内在激酶活性,但可被HER2磷酸化,其在MDA-MB-175-VII和NCI-N87细胞中的磷酸化也被sevabertinib抑制。
具有HER2改变的细胞系未表达可检测水平的EGFR蛋白;NCI-2170和NCI-N87磷酸化EGFR免疫印迹中的磷酸化条带可能是由于磷酸化EGFR抗体与磷酸化HER2的交叉反应所致,磷酸化HER2更大,在SDS-PAGE中迁移较慢。仅在过表达野生型EGFR的A431细胞中,在最高浓度的sevabertinib下观察到对磷酸化EGFR、磷酸化MEK或磷酸化ERK的抑制,这与sevabertinib对野生型EGFR活性降低一致。
由于观察到一部分携带ERBB2扩增的癌细胞系对sevabertinib有反应,分析了乳腺癌和胃食管癌细胞系(两者均以复发性ERBB2扩增为特征)的反应与ERBB2扩增之间的相关性。乳腺癌和胃食管癌细胞系对sevabertinib的反应与存在高水平、局灶性ERBB2扩增相关,并且在携带野生型ERBB2扩增的胃癌细胞系NCI-N87中,sevabertinib有效抑制了HER2和下游信号蛋白的磷酸化。这些结果表明sevabertinib在携带ERBB2扩增的癌症患者中也可能具有活性。
Sevabertinib在两名HER2外显子20插入突变NSCLC患者中显示出抗肿瘤活性
在一项针对携带HER2突变的晚期NSCLC患者的sevabertinib首次人体研究中观察到了有希望的临床活性。此处介绍了两名携带HER2外显子20插入突变NSCLC患者接受每天两次20 mg sevabertinib治疗的病例研究。
一名51岁女性患者在进入试验前接受了两种全身治疗:一线培美曲塞和卡铂治疗4个月,二线多西他赛治疗2个月。该患者在接受sevabertinib治疗6、18和30周后分别达到41%、52%和53%的肿瘤缩小,达到部分缓解。尽管存在非靶病灶脑转移且在治疗前30周内保持稳定,但研究治疗30周后脑转移灶增大导致疾病进展。该患者总共接受了10个周期治疗,共219天,未进行永久性剂量降低。
一名55岁男性患者接受培美曲塞和卡铂作为一线治疗约6个月。进入试验后,该患者在治疗6周和54周后分别达到54%和78%的肿瘤缩小,达到部分缓解,直至治疗80周后发生疾病进展。该患者总共接受了28个周期治疗,共602天,未进行永久性剂量降低。该患者未观察到脑转移。

图2 sevabertinib是一种针对HER2外显子20插入突变的高效选择性抑制剂
讨论
目前,携带HER2外显子20插入的肺癌患者预后差,靶向治疗选择有限。尽管T-DXd和zongertinib已获得加速批准用于治疗携带HER2外显子20插入的NSCLC患者,但仍需要为这些患者提供有效且耐受性良好的口服疗法。重要的是,针对HER2外显子20插入NSCLC患者的疗法必须对相关的EGFR酪氨酸激酶受体活性降低,以最大限度地减少EGFR驱动的毒性。Sevabertinib是一种口服、可逆的HER2外显子20插入抑制剂,在同基因Ba/F3细胞测定中相对于野生型EGFR具有约20倍的选择性。在Ba/F3和癌细胞系存活测定、检查信号蛋白磷酸化的癌细胞系机制测定以及使用HER2 A775insYVMA PDX模型和细胞系来源异种移植模型的体内实验中证明了sevabertinib的活性和选择性。还提供了数据证明在参加1/2期试验的两名肺癌患者中sevabertinib具有抗肿瘤活性,导致两次部分缓解。
除了肺癌中的HER2外显子20插入,还观察到sevabertinib对一部分ERBB2扩增的乳腺癌、胃癌和食管癌细胞系具有活性。这一发现暗示sevabertinib在这些癌症患者中也可能具有活性,但需要注意的是,由于肿瘤异质性和共存突变,预计胃食管癌对HER2靶向药物的反应有限。还在同基因Ba/F3系统中观察到sevabertinib对HER2激活点和致癌点突变的活性,但有趣的是,未鉴定出内源性携带类似一组激活HER2点突变的敏感癌细胞系。这意味着具有内源性HER2错义突变的癌细胞系可能具有其他支持癌细胞存活和增殖而不依赖于突变HER2活性的致癌改变,或者可能具有掩盖HER2失活影响的生长特性。相反,确实观察到sevabertinib对内源性携带NRG1致癌易位的乳腺癌细胞系具有活性,这表明sevabertinib在这些罕见患者中也可能显示活性。Sevabertinib对具有经典激活突变和EGFR外显子20插入的癌细胞系也具有活性。最后,在23个对sevabertinib最敏感的细胞系中的13个中未检测到相关的基因组改变,这引发了关于这13个细胞系为何对sevabertinib敏感的问题。表观遗传改变可能是导致敏感性的原因,但需要进一步研究来解决这个问题。
除了sevabertinib,zongertinib也正在临床研究中评估其对携带HER2突变的肺癌患者的疗效。两种分子在具有ERBB改变的癌细胞系中具有相似的临床前功效。这两种抑制剂之间的主要区别在于sevabertinib是可逆的,而zongertinib是不可逆的,共价修饰HER2中的C805。因此,C805的突变将消除zongertinib的活性,而sevabertinib不受C805突变的影响。zongertinib的第一个1期临床数据现已报道,在携带HER2酪氨酸激酶结构域突变的NSCLC患者中,客观缓解率高达71%。有趣的是,在HER2突变位于酪氨酸激酶结构域之外的NSCLC患者中也观察到了一些反应。由于EGFR抑制和HER2抑制的毒性特征被认为部分重叠,因此很难预测sevabertinib和zongertinib的安全性特征是否存在差异,因为两者都抑制野生型HER2。Sevabertinib和zongertinib均处于3期临床试验阶段;它们之间的进一步区分有待这些临床试验结果。
总之,已经在携带HER2外显子20插入的NSCLC的细胞和体内模型中证明了sevabertinib的临床前活性。这种活性扩展到一部分携带ERBB2局灶扩增的癌细胞系。进一步提供了两名携带HER2外显子20插入的肺癌患者对sevabertinib产生反应的证据。针对携带HER2突变的NSCLC患者的sevabertinib 1期试验正在进行中。Sevabertinib在NSCLC中的3期试验和针对HER2突变实体瘤的2期开放性篮子试验现已开始招募患者。
参考资料
[1] Sevabertinib, a Reversible HER2 Inhibitor with Activity in Lung Cancer



