自2019年年底开始,新型冠状病毒(SARS-CoV-2)引起的新冠肺炎(COVID-19)疫情一直在全球范围内流行,全球死亡率居高不下,已经导致全球的公共卫生危机。COVID-19的临床症状多样,从发烧、乏力、干咳到呼吸困难,从轻度肺炎到急性肺损伤(ALI)和严重病例的急性呼吸窘迫综合征均可出现。
与SARS-CoV类似,SARS-CoV-2属于冠状病毒科冠状病毒属,是一种包膜单链阳性RNA病毒。人血管紧张素转换酶2(hACE2)已被证实是SARS-CoV-2的功能性受体。目前在各个国家都已开展对SARS-CoV-2的相关研究,一些hACE2表达小鼠模型,如hACE2转基因小鼠,AAV-hACE2转导小鼠和Ad5-hACE2转导小鼠已经被开发出来。然而,大多数模型只会对小鼠造成轻度至中度的肺损伤。一种能够重现COVID-19严重呼吸道症状和高病死率的小动物模型仍然是当务之急。
近日,中国军事科学院军事医学研究院秦成峰/王慧团队联合中科院生物物理所王祥喜团队在期刊《Nature Communications》上在线发表了题为“Characterization and structuralbasis of a lethal mouse-adapted SARS-CoV-2”的研究论文,公开表示团队成功建立新冠肺炎重症模型并揭示新冠病毒跨种感染分子机制。

首先,研究团队在之前的研究中已经生成了一株SARS-CoV-2 (MASCp6)小鼠适应株,能对小鼠造成中度肺损伤。在此基础上,研究人员进一步连续传代30次,以产生更强毒力的小鼠适应株,在第36代产生了SARS-CoV-2(命名为MASCp36)。
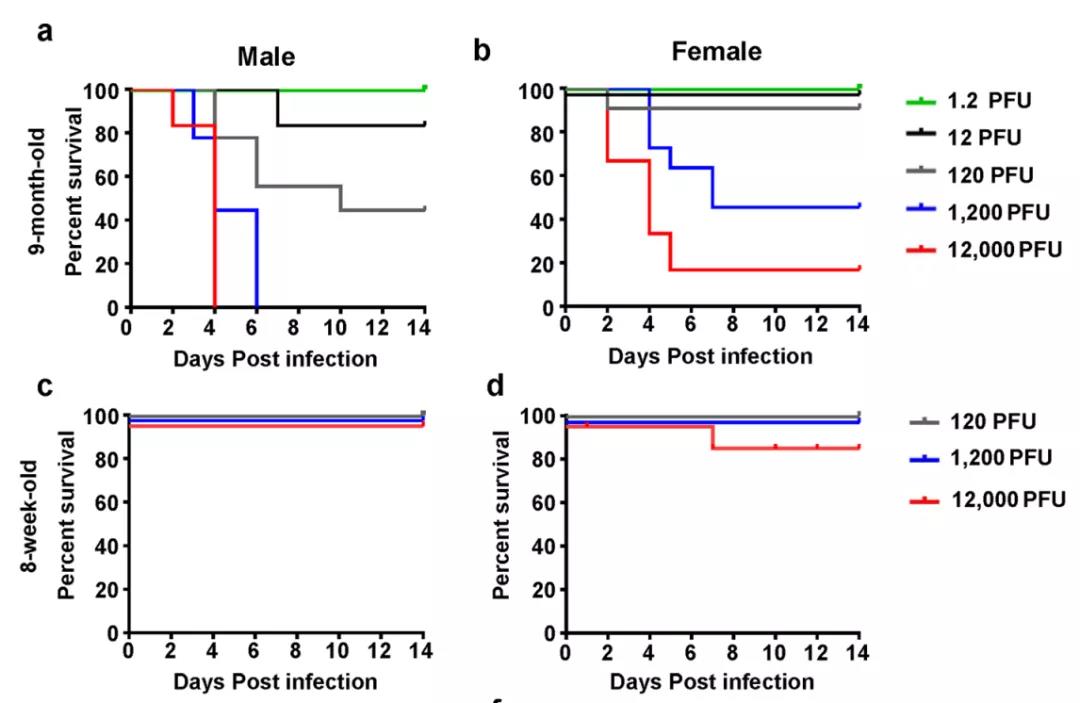
实验表明,对不同月龄、性别的BALB/c小鼠进行不同剂量的鼻内注射后,9月龄小鼠对MASCp36毒性高度敏感,且对MASCp36毒性呈剂量依赖性。所有9个月大的小鼠受到高剂量MASCp36的攻击后,均出现典型的呼吸道症状,并表现出皮毛皱褶、驼背和活动减少等特征。此外,雄性小鼠比雌性小鼠对MASCp36更敏感。
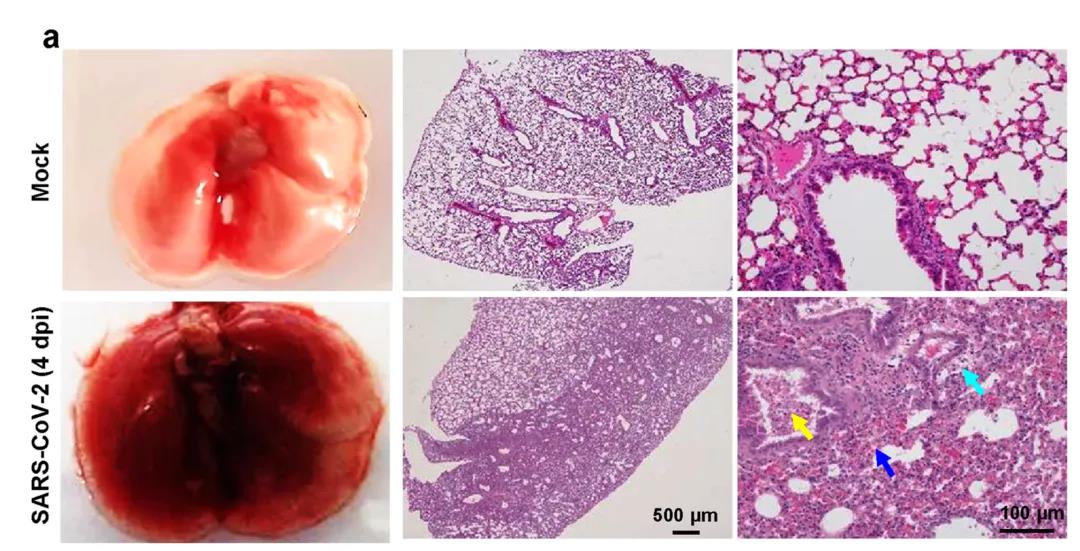
为了进一步确定MASCp36感染小鼠的病理结果,研究团队收集了肺组织进行组织病理学和免疫染色分析。裸眼观察发现,与未感染的对照动物相比,MASCp36感染小鼠的肺损伤严重,双侧呈红色,肺内有黏液。镜下观察可见细支气管管内大量脱皮上皮细胞(黄色箭头),肺泡上皮细胞大面积坏死,肺泡壁融合炎性细胞浸润,以中性粒细胞为主。血管周围严重水肿(青色箭头),散在出血(蓝色箭头),这都表明MASCp36感染诱发了坏死性肺炎和广泛弥漫性肺泡损伤。
后面,研究团队就此模型进行了一系列深入的研究,深度测序发现MASCp36在连续传代中共检测到12个氨基酸突变位点,其中3个(N501Y、Q493H和K417N)位于S蛋白受体结合区(RBD),进一步实验证实,这一结构使得MASCp36病毒和鼠源ACE2亲和力显著增加,通过电镜发现,致死株MASCp36的RBD与鼠源ACE2可形成稳定结合的致密结构,这与野生型病毒RBD与人源ACE2的结构高度类似。
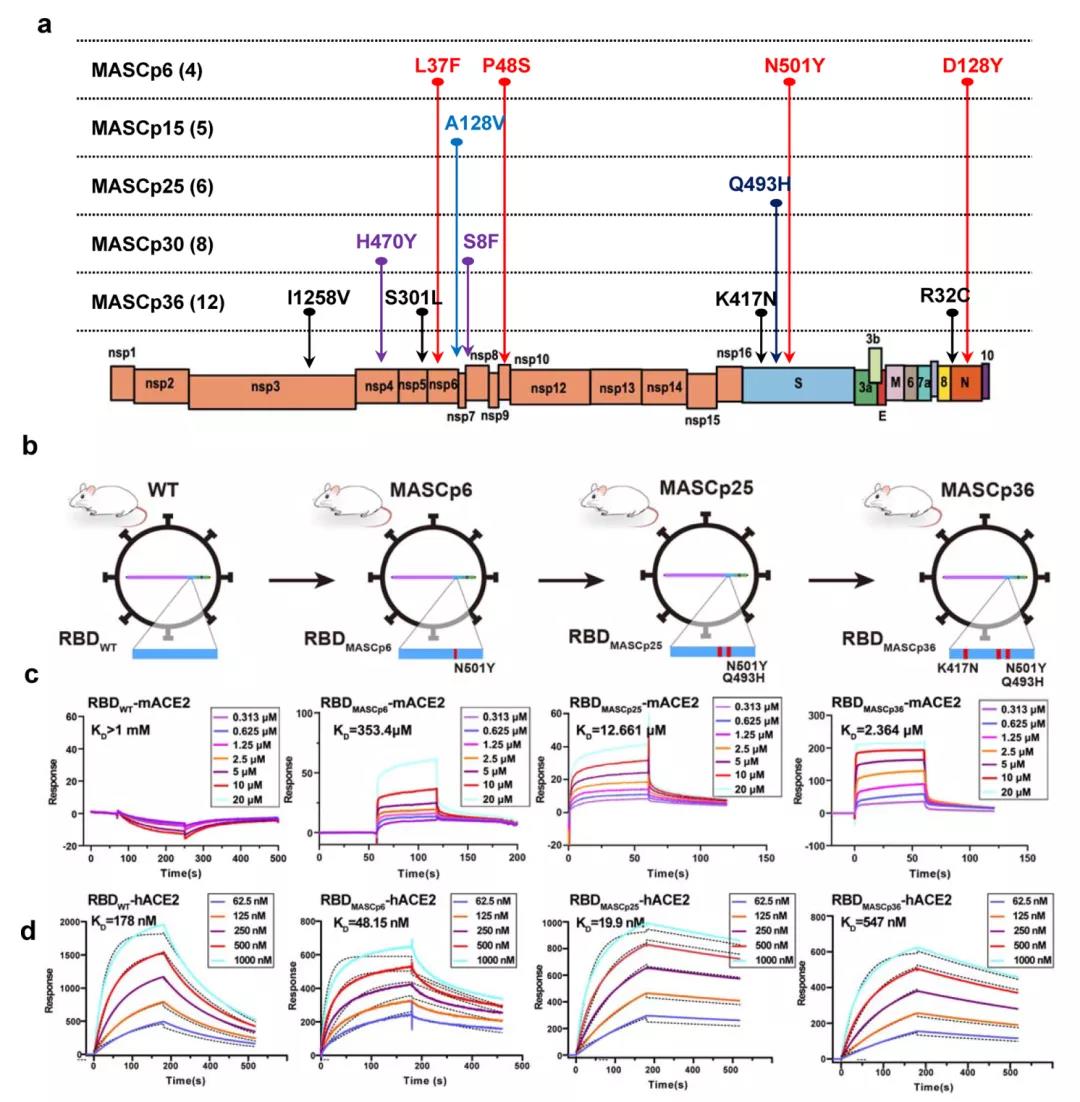
综上所述,这一研究产生了一种新的小鼠适应的SARS-CoV-2毒株MASCp36,该毒株会导致严重的呼吸道症状和死亡率。模型也显示了与严重COVID-19类似的年龄和性别相关死亡率。在体内传代过程中,通过对MASCp36受体结合区域(RBD)的深度测序,发现了N501Y、Q493H和K417N三个氨基酸替换。本研究为明确SARS-CoV-2发病机制提供了平台,并揭示了其快速适应和进化的分子机制。



