光吃不胖,是吃货们永恒的追求。然而热量第一定律告诉我们,吃太多,总是要胖的。令人激动的是,近期科学家们找到了一种颠覆性的“燃脂”方法,或许无需药理刺激,便能长久地促进脂肪燃烧。
当地时间5月27日,期刊《Cell》在线发布了一项由哥本哈根大学诺和诺德基金会基础代谢研究中心领衔带来的研究报告。文章指出,研究人员已经发现了一个调动棕色脂肪组织(BAT)的有效靶标,通过基因工程提高该基因在小鼠体内的表达水平后,即使长期暴露于高脂饮食下,小鼠也能免受代谢疾病困扰,享“瘦”美食,并且该方法还具有持久生效的潜力。

一条独特的燃脂路径
众所周知,棕色脂肪组织(BAT)是燃脂“小能手”,能够加快人体新陈代谢,促进白色脂肪消耗,这一特点使其成为治疗代谢性疾病的理想靶点。然而,BAT通常仅在寒冷环境下由β-肾上腺素受体(β-AR)激活而起作用,尽管科学家们一直在尝试药理激活β-AR从而促进BAT燃烧,但是这类方法却存在着增加心率和血压等副作用。
兴奋性G蛋白(Gs)偶联受体家族被证实是BAT激活的主要诱因,在脂肪产热的急性期和适应性期起调节作用。
在这项新研究中,研究人员通过qPCR阵列从小鼠体内44种Gs偶联受体中找到了冷诱导下表达较为显著的Gpr3受体。有趣的是,与其他受体不同,Gpr3受体无需外在配体,其氨基末端(N-末端)就能赋予该受体信号转导活性,这说明,Gpr3可能将具有长久的BAT激活效果。
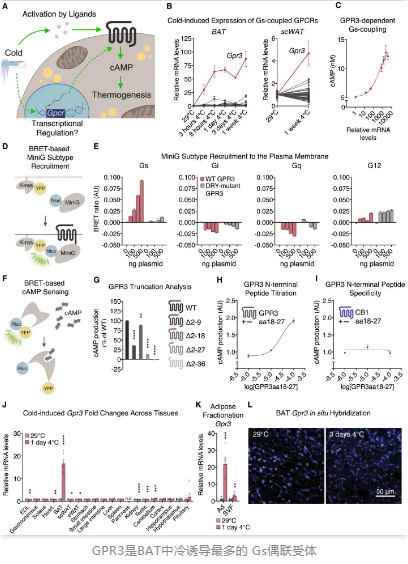
令人惊讶的是,Gpr3介导的BAT产热似乎并不依赖β-AR路径。在敲除了β-AR基因后,小鼠仍具有高表达的Gpr3,更为重要的是,Gpr3的过表达抑制了β-肾上腺素受体的表达。这些情况说明,Gpr3是通过一种新的机制介导BAT产热。
更安全、更燃脂、更长效
当然,关键问题在于,这条新发现的通路是否具备更优异的燃脂效果、更高的安全性和更好的临床转化可能性。
在进一步试验中,研究人员通过基因工程改造和慢病毒诱导小鼠体内Gpr3过表达,结果发现,此时BAT能耗更大,脂肪组织显著减少,小鼠血糖得到更好的控制。同时,与β-肾上腺素受体相比,GPR3引起的BAT活化更“偏爱”脂质这一能耗来源。
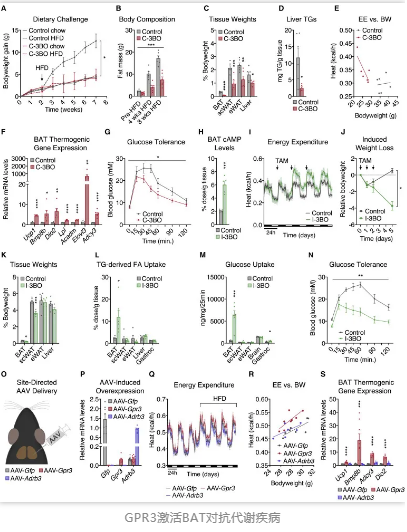
更为重要的是,提高棕色脂肪细胞中GPR3受体的表达水平能够调节肥胖症小鼠体内的代谢稳态,帮助其恢复正常的代谢功能。这种效果并不需要长期给药才能实现,研究人员发现,仅需对小鼠注射一次携带GPR3的慢病毒颗粒,至少能够维持1个多月的效果。
Gpr3在小鼠中表现出良好的BAT调控潜力,但是该靶点是否同样适用于人体呢?研究人员评估了体重指数(BMI)和糖耐量水平不同的人类志愿者的锁骨BAT中GPR3基因的表达,发现较高水平的BAT GPR3与较低的BMI显著相关,说明人体内GPR3的表达与全身代谢健康有关。
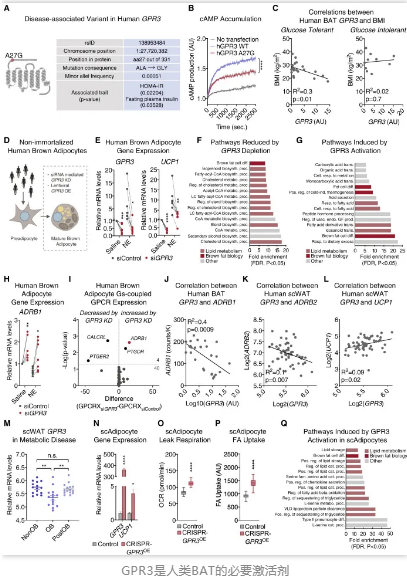
该报告的作者、哥本哈根大学诺和诺德基金会基础代谢研究中心的Olivia Sveidahl Johansen博士说:“我们的研究表明,通过使用基因工具增加肥胖小鼠体内GPR3的表达,能够减轻体重,恢复正常的血糖控制。GPR3激活了棕色脂肪细胞,将血液中的碳水化合物和脂质全都消耗掉了。”
总之,这项研究揭示了一种激活BAT的全新路径,GPR3是激活人BAT不可或缺的调节因子,具有长久生效的潜力。目前,研究人员正在探索利用GPR3治疗肥胖以及其他代谢性疾病的潜在策略。期待该方法能够早日应用于临床!



