严重急性呼吸系统综合征冠状病毒2型(Severe Acute Respiratory Syndrome Coronavirus 2,SARS-CoV-2)造成了新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)的大流行。尽管COVID-19疫苗的研发取得了巨大的成功,但由于毒株的频繁变异和全球较低的疫苗接种率,SARS-CoV- 2大流行对人类健康带来了持久的挑战,因此迫切需要研发针对SARS-CoV-2变异毒株的新型广谱治疗方法。
美国西北大学医学院和美国德州大学MD安德森癌症中心在Nature Communications杂志上发表了一项新发现,该研究发现新冠肺炎患者的血液中存在含有血管紧张素转化酶2蛋白的天然纳米级大小的囊泡-evACE2,它具有先天广谱抗病毒机制,可阻止不同变异类型新冠病毒毒株的感染,包括已经出现的多种新冠病毒变异株和未来可能出现的冠状病毒。

研究成果(图源:Nature Communications)
SARS-CoV-2的野生株(WT)和突变株通过进入受体血管紧张素转换酶2(Angiotensin Converting Enzyme 2,ACE2)感染宿主细胞,如人肺细胞。细胞外囊泡(Extracellular vesicles,EV)是血液等液体的重要组成部分之一,包括外泌体和微囊泡。外泌体是具特征的小型EV之一,可能参与多种生理和病理生物学功能,或可作为新的生物标记物和下一代生物疗法。从植物和人类样本中提取的外泌体已应用于临床试验,用于治疗炎症性疾病和癌症。根据EV领域广泛采用的命名法以及分离异源囊泡群的可能性,研究人员将其中富集的外泌体统称为“EVs”。
研究人员对人类血浆样品中的EVs进行MFV分析,发现COVID-19患者的血浆中ACE2+EVs升高,与血清阴性对照组相比,急性期有较大幅度的增加,恢复期有适度的增加。SARS-CoV-2感染触发了过量表达ACE2的人肺细胞A549细胞分泌ACE2+TSG101+EVs,这意味着ACE2+EVs上调是COVID-19患者对SARS-CoV-2感染的先天反应。
研究人员应用人类细胞系HEK-293(HEK)和HeLa,用于表征EVs中ACE2表达,并测定evACE2对SARS-CoV-2的结合活性和中和功能。实验表明,evACE2富集在小的EVs中,在假定的外泌体中检测到的可能性很小。进一步研究表明,SARS-CoV-2进入受体ACE2蛋白,在EVs上表达。
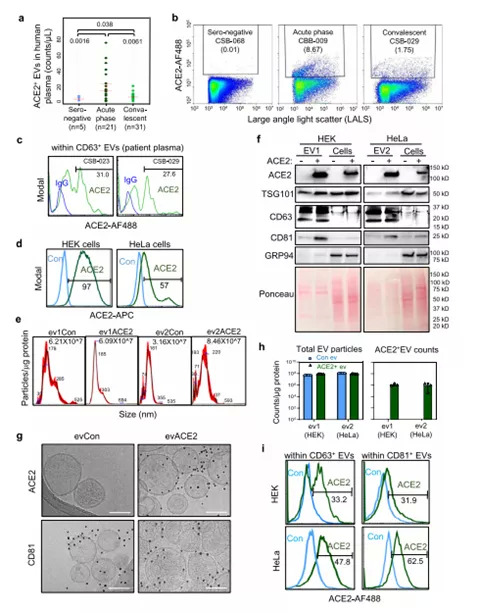
COVID-19患者的外周血中EVs增加(图源:Nature Communications)
研究人员通过评估SARS-CoV-2 蛋白与人类宿主细胞的结合来分析evACE2对病毒附着和感染的影响。正如预期的那样,ACE2HEK细胞与红色荧光团AF-647结合的RBD蛋白表现出特异且稳定的结合。相比之下,等量的ACE2EV的效果可以忽略不计,这表明ACE2EV通过诱导ACE2抑制其细胞受体ACE2对EV的SARS-CoV-2 RBD识别。作为阳性对照,rhACE2也抑制RBD与人类ACE2细胞的结合。对比分析发现,evACE2比rhACE2更有效地阻断SARS-CoV-2 RBD与人类宿主细胞的结合。
接下来,研究人员又评估了evACE2和rhACE2对SARS-CoV-2及其变种的中和作用。结果表明,与rhACE2相比,ev1ACE2(HEK)和ev2ACE2(HeLa)在阻断假病毒感染方面的中和效率估计分别高出58倍和34倍。鉴于实验设置限制,还需进一步实验。实验数据表明,evACE2在阻断SARS-CoV-2病毒感染方面至少达到了估计的80倍的中和效果,PCR测试也验证了这一结果。
为了研究evACE2中和SARSCoV-2变体的潜力,团队采用假型和真实SARS-CoV-2感染试验。与WT相比,evACE2在阻断假型SARS-CoV-2变体的感染方面取得了高达4至5倍的功效,这些变体表达了B1.1.7(α变体)、B1.351(β变体)和B.1.617.2(δ变体)的S蛋白突变体。在evACE2介导的对SARS-CoV-2变体的中和作用中也得到了类似的结果,其中evACE2对α和β变体的感染的抑制效果与WT相似或更大。总而言之,研究结果支持evACE2作为一种创新方法来预防或限制SARS-CoV-2病毒感染,包括WT和变异株。
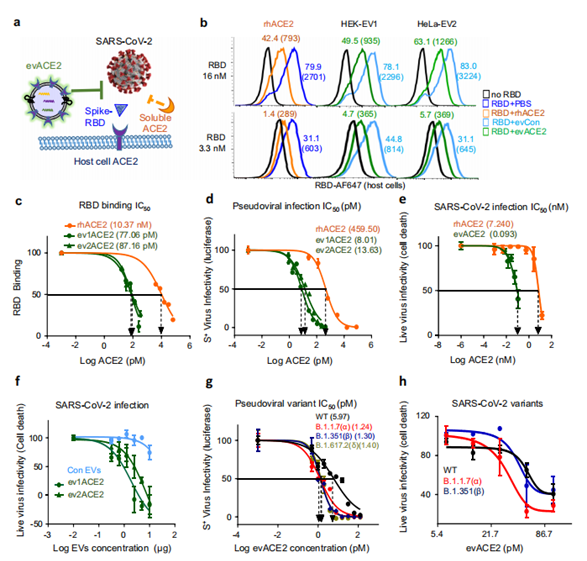
evACE2对RBD结合和SARS-CoV-2变异感染的中和作用(图源:Nature Communications)
先前研究发现evACE2可能存在先天抗病毒机制,研究人员对此进行了细致研究。血浆中和活性对ACE2+EVs和RBD-IgG水平的多变量线性回归显示比单独的RBD-IgG水平提高(模型的拟合度),这一结果支持ACE2+EVs具有潜在抗病毒贡献。为了确定血浆EVs对中和功能的贡献,研究人员从血清阴性对照组和COVID-19患者的血浆样品中分离出EVs,质谱分析证实了ACE2和EV蛋白的存在。
值得注意的是,从6名急性期COVID-19患者中的5名血浆中分离出的EV颗粒,尤其是CBB-007和CBB-012(未检测到RBD-IgG)完全阻断了SARS-CoV-2感染引起的细胞死亡。血清阴性对照组和没有检测到ACE2 EVs的CBB-005未显示任何病毒中和作用,这表明血浆中的ACE2+ EVs水平可能受SARS-CoV2感染调控。因此,研究人员又耗尽血浆颗粒中的大部分ACE2+EVs,其从五个血浆样本(康复期的CSB-012和CSB-24,以及急性期的CBB-008、009和013)中分离出的ACE2+EVs的耗竭,明显削弱了血浆EVs中和RBD与ACE2+HEK细胞结合的能力,这表明COVID-19患者血浆中的ACE2+EVs至少是抗SARS-CoV-2活性的部分原因。
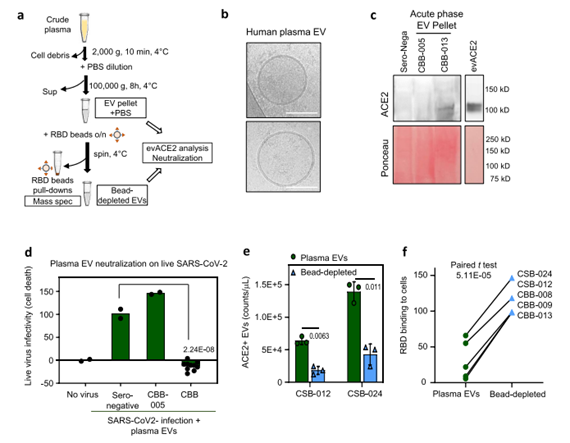
患者血浆中的evACE2能中和SARS-CoV-2(图源:Nature Communications)
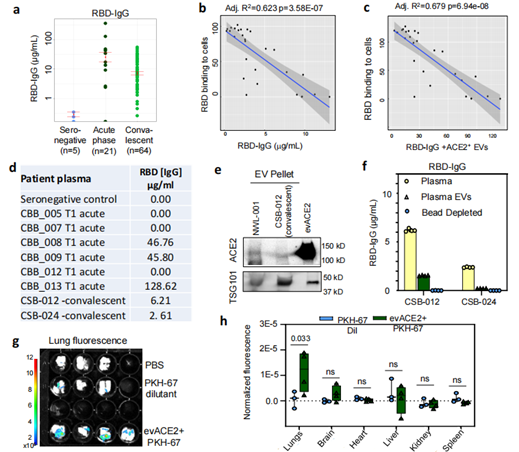
治疗性evACE2的患者血浆分析和小鼠生物分布情况(图源:Nature Communications)
为了验证发现的evACE2是否能作为治疗COVID-19的诱饵疗法,研究人员使用已建立的hACE2转基因COVID-19小鼠模型评估了其临床前疗效。双盲病理评分显示,evACE2治疗在很大程度上减少了SARS-CoV-2感染小鼠的肺部炎症。与对照组EV治疗的小鼠相比,肺泡出血和坏死评分明显降低。进一步验证鼻腔递送的ACE2+EVs的研究表明,evACE2在治疗COVID-19发病机制方面取得了良好的临床前疗效。
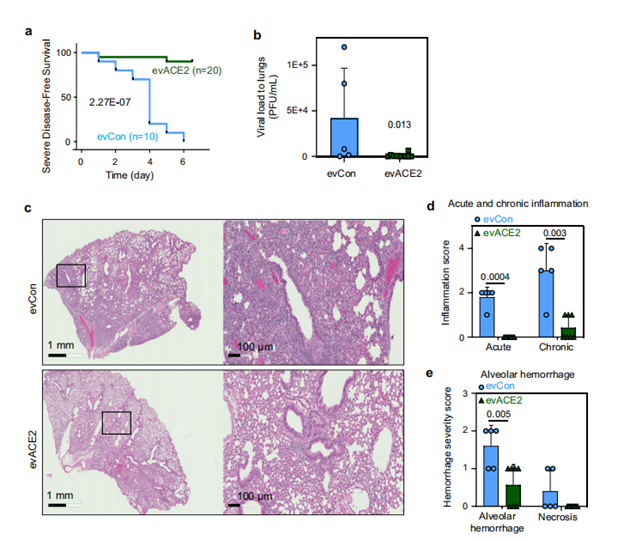
 (图源:Nature Communications)
(图源:Nature Communications)研究团队已经确定evACE2是一种创新的诱饵疗法,可以有效地阻断SARS-CoV-2及其变体引起的传染病,并可能阻断所有未来出现的利用ACE2作为其初始连接受体的冠状病毒。目前,团队正在申请有关evACE2的专利,开发evACE2作为预防和治疗新冠肺炎的生物治疗产品。
参考资料:
严重急性呼吸系统综合征冠状病毒2型(Severe Acute Respiratory Syndrome Coronavirus 2,SARS-CoV-2)造成了新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)的大流行。尽管COVID-19疫苗的研发取得了巨大的成功,但由于毒株的频繁变异和全球较低的疫苗接种率,SARS-CoV- 2大流行对人类健康带来了持久的挑战,因此迫切需要研发针对SARS-CoV-2变异毒株的新型广谱治疗方法。
美国西北大学医学院和美国德州大学MD安德森癌症中心在Nature Communications杂志上发表了一项新发现,该研究发现新冠肺炎患者的血液中存在含有血管紧张素转化酶2蛋白的天然纳米级大小的囊泡-evACE2,它具有先天广谱抗病毒机制,可阻止不同变异类型新冠病毒毒株的感染,包括已经出现的多种新冠病毒变异株和未来可能出现的冠状病毒。

研究成果(图源:Nature Communications)
SARS-CoV-2的野生株(WT)和突变株通过进入受体血管紧张素转换酶2(Angiotensin Converting Enzyme 2,ACE2)感染宿主细胞,如人肺细胞。细胞外囊泡(Extracellular vesicles,EV)是血液等液体的重要组成部分之一,包括外泌体和微囊泡。外泌体是具特征的小型EV之一,可能参与多种生理和病理生物学功能,或可作为新的生物标记物和下一代生物疗法。从植物和人类样本中提取的外泌体已应用于临床试验,用于治疗炎症性疾病和癌症。根据EV领域广泛采用的命名法以及分离异源囊泡群的可能性,研究人员将其中富集的外泌体统称为“EVs”。
研究人员对人类血浆样品中的EVs进行MFV分析,发现COVID-19患者的血浆中ACE2+EVs升高,与血清阴性对照组相比,急性期有较大幅度的增加,恢复期有适度的增加。SARS-CoV-2感染触发了过量表达ACE2的人肺细胞A549细胞分泌ACE2+TSG101+EVs,这意味着ACE2+EVs上调是COVID-19患者对SARS-CoV-2感染的先天反应。
研究人员应用人类细胞系HEK-293(HEK)和HeLa,用于表征EVs中ACE2表达,并测定evACE2对SARS-CoV-2的结合活性和中和功能。实验表明,evACE2富集在小的EVs中,在假定的外泌体中检测到的可能性很小。进一步研究表明,SARS-CoV-2进入受体ACE2蛋白,在EVs上表达。

COVID-19患者的外周血中EVs增加(图源:Nature Communications)
研究人员通过评估SARS-CoV-2 蛋白与人类宿主细胞的结合来分析evACE2对病毒附着和感染的影响。正如预期的那样,ACE2HEK细胞与红色荧光团AF-647结合的RBD蛋白表现出特异且稳定的结合。相比之下,等量的ACE2EV的效果可以忽略不计,这表明ACE2EV通过诱导ACE2抑制其细胞受体ACE2对EV的SARS-CoV-2 RBD识别。作为阳性对照,rhACE2也抑制RBD与人类ACE2细胞的结合。对比分析发现,evACE2比rhACE2更有效地阻断SARS-CoV-2 RBD与人类宿主细胞的结合。
接下来,研究人员又评估了evACE2和rhACE2对SARS-CoV-2及其变种的中和作用。结果表明,与rhACE2相比,ev1ACE2(HEK)和ev2ACE2(HeLa)在阻断假病毒感染方面的中和效率估计分别高出58倍和34倍。鉴于实验设置限制,还需进一步实验。实验数据表明,evACE2在阻断SARS-CoV-2病毒感染方面至少达到了估计的80倍的中和效果,PCR测试也验证了这一结果。
为了研究evACE2中和SARSCoV-2变体的潜力,团队采用假型和真实SARS-CoV-2感染试验。与WT相比,evACE2在阻断假型SARS-CoV-2变体的感染方面取得了高达4至5倍的功效,这些变体表达了B1.1.7(α变体)、B1.351(β变体)和B.1.617.2(δ变体)的S蛋白突变体。在evACE2介导的对SARS-CoV-2变体的中和作用中也得到了类似的结果,其中evACE2对α和β变体的感染的抑制效果与WT相似或更大。总而言之,研究结果支持evACE2作为一种创新方法来预防或限制SARS-CoV-2病毒感染,包括WT和变异株。

evACE2对RBD结合和SARS-CoV-2变异感染的中和作用(图源:Nature Communications)
先前研究发现evACE2可能存在先天抗病毒机制,研究人员对此进行了细致研究。血浆中和活性对ACE2+EVs和RBD-IgG水平的多变量线性回归显示比单独的RBD-IgG水平提高(模型的拟合度),这一结果支持ACE2+EVs具有潜在抗病毒贡献。为了确定血浆EVs对中和功能的贡献,研究人员从血清阴性对照组和COVID-19患者的血浆样品中分离出EVs,质谱分析证实了ACE2和EV蛋白的存在。
值得注意的是,从6名急性期COVID-19患者中的5名血浆中分离出的EV颗粒,尤其是CBB-007和CBB-012(未检测到RBD-IgG)完全阻断了SARS-CoV-2感染引起的细胞死亡。血清阴性对照组和没有检测到ACE2 EVs的CBB-005未显示任何病毒中和作用,这表明血浆中的ACE2+ EVs水平可能受SARS-CoV2感染调控。因此,研究人员又耗尽血浆颗粒中的大部分ACE2+EVs,其从五个血浆样本(康复期的CSB-012和CSB-24,以及急性期的CBB-008、009和013)中分离出的ACE2+EVs的耗竭,明显削弱了血浆EVs中和RBD与ACE2+HEK细胞结合的能力,这表明COVID-19患者血浆中的ACE2+EVs至少是抗SARS-CoV-2活性的部分原因。

患者血浆中的evACE2能中和SARS-CoV-2(图源:Nature Communications)

治疗性evACE2的患者血浆分析和小鼠生物分布情况(图源:Nature Communications)
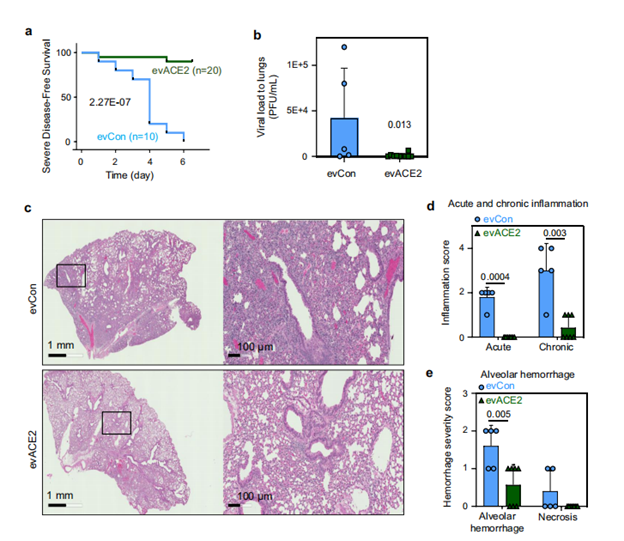
为了验证发现的evACE2是否能作为治疗COVID-19的诱饵疗法,研究人员使用已建立的hACE2转基因COVID-19小鼠模型评估了其临床前疗效。双盲病理评分显示,evACE2治疗在很大程度上减少了SARS-CoV-2感染小鼠的肺部炎症。与对照组EV治疗的小鼠相比,肺泡出血和坏死评分明显降低。进一步验证鼻腔递送的ACE2+EVs的研究表明,evACE2在治疗COVID-19发病机制方面取得了良好的临床前疗效。

 (图源:Nature Communications)
(图源:Nature Communications)研究团队已经确定evACE2是一种创新的诱饵疗法,可以有效地阻断SARS-CoV-2及其变体引起的传染病,并可能阻断所有未来出现的利用ACE2作为其初始连接受体的冠状病毒。目前,团队正在申请有关evACE2的专利,开发evACE2作为预防和治疗新冠肺炎的生物治疗产品。
参考资料:



