研究人员已经确定了癌症进化中一个以前未被认识到的关键角色:发生在基因组特定区域的突变簇。这些突变簇有助于约10%的人类癌症的进展,并可用于预测患者的生存率。
该研究结果发表在2月9日出版的《Nature》杂志上。
这项研究揭示了一类被称为聚集体细胞突变的突变——聚集意味着它们在细胞基因组的特定区域聚集在一起,而体细胞意味着它们不是遗传的,而是由内部和外部因素引起的,比如衰老或暴露在紫外线辐射下。
到目前为止,聚集的体细胞突变一直是癌症发展中一个有待研究的领域。但加州大学圣地亚哥分校生物工程、细胞和分子医学教授Ludmil Alexandrov实验室的研究人员发现,这些突变非常不寻常,值得进一步研究。
“我们通常会看到基因组中随机发生的体细胞突变。但当我们仔细观察这些突变时,我们发现它们发生在这些热点地区。这就像在地上扔球,然后突然看到它们聚集在一个空间,”Alexandrov说。“所以我们不禁想知道:这里发生了什么?为什么会有热点?它们与临床相关吗?它们能告诉我们癌症是如何发展的吗?”
Alexandrov实验室的生物工程博士生、该研究的第一作者Erik Bergstrom说:“聚集性突变在很大程度上被忽视了,因为它们只占所有突变的很小一部分。但通过深入研究,我们发现它们在人类癌症的病因学中发挥着重要作用。”
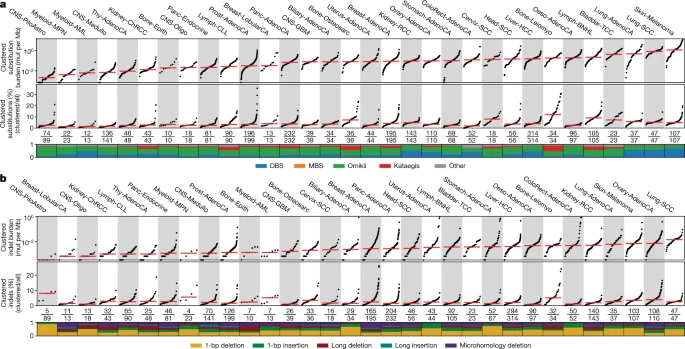
聚集体细胞突变
该团队的发现是通过创建全面和详细的已知聚集体细胞突变的地图而实现的。他们首先绘制了2500多名癌症患者基因组中的所有突变(聚集突变和非聚集突变),这项工作总共包含了30种不同的癌症类型。研究人员使用亚历山德罗夫实验室开发的下一代人工智能方法绘制了他们的地图。该团队使用这些算法来检测个体患者中的聚集突变,并阐明导致这些事件的潜在突变过程。他们发现,在大约10%的人类癌症中,聚集的体细胞突变有助于癌症的进化。
更进一步,研究人员还发现,一些癌症驱动簇——特别是那些在已知的癌症驱动基因中发现的——可以用来预测患者的总体生存率。例如,BRAF基因(黑色素瘤中广泛观察的驱动基因)的聚集突变的存在,比非聚集突变的个体带来更好的总体患者生存。同时,EGFR基因(肺癌中广泛观察的驱动基因)的聚集突变的存在导致患者生存期的下降。
“重要的是,我们看到仅从这些基因中检测到的聚集突变就能产生不同的生存率,这是可以用临床常用的现有平台检测到的。因此,这是一个非常简单和精确的患者生存生物标记。”
“这项出色的工作强调了开发人工智能方法来阐明肿瘤生物学的重要性,以及使用可直接转化为临床视线的标准平台来发现和快速开发生物标志物的重要性。”摩尔斯癌症中心主任、加州大学圣地亚哥分校癌症研究和护理副校长Scott Lippman说。“这凸显了加州大学圣地亚哥分校在结合工程方法和人工智能解决当前癌症医学问题方面的优势。”
癌症进化的新模式
在这项研究中,研究人员还确定了导致聚集性体细胞突变的各种因素。这些因素包括紫外线辐射、饮酒、吸烟,值得注意的是,一种叫做APOBEC3的抗病毒酶的活性。
APOBEC3酶通常存在于细胞内部,作为细胞内部免疫反应的一部分。它们的主要工作是切断任何进入细胞的病毒。但在癌细胞中,研究人员认为APOBEC3酶可能弊大于利。
研究人员发现,癌细胞中通常充满了携带着已知癌症驱动基因的染色体外DNA (ecDNA)环状结构,在单个ecDNA分子中存在着聚集的突变。研究人员将这些突变归因于APOBEC3酶的活性。他们假设APOBEC3酶误将外链DNA的环当成外来病毒,并试图限制和切断它们。在此过程中,APOBEC3酶导致单个ecDNA分子内形成突变簇。这反过来又在加速癌症进化和可能导致耐药性方面发挥了关键作用。研究人员将这些聚集的突变环命名为kyklonas,这是希腊语中气旋的意思。
Alexandrov说:“这是一种全新的肿瘤发生模式。”他解释说,随着团队的其他发现,“这为新的治疗方法奠定了基础,临床医生可以考虑限制APOBEC3酶的活性和/或针对染色体外DNA的癌症治疗。”
参考资料:
研究人员已经确定了癌症进化中一个以前未被认识到的关键角色:发生在基因组特定区域的突变簇。这些突变簇有助于约10%的人类癌症的进展,并可用于预测患者的生存率。
该研究结果发表在2月9日出版的《Nature》杂志上。
这项研究揭示了一类被称为聚集体细胞突变的突变——聚集意味着它们在细胞基因组的特定区域聚集在一起,而体细胞意味着它们不是遗传的,而是由内部和外部因素引起的,比如衰老或暴露在紫外线辐射下。
到目前为止,聚集的体细胞突变一直是癌症发展中一个有待研究的领域。但加州大学圣地亚哥分校生物工程、细胞和分子医学教授Ludmil Alexandrov实验室的研究人员发现,这些突变非常不寻常,值得进一步研究。
“我们通常会看到基因组中随机发生的体细胞突变。但当我们仔细观察这些突变时,我们发现它们发生在这些热点地区。这就像在地上扔球,然后突然看到它们聚集在一个空间,”Alexandrov说。“所以我们不禁想知道:这里发生了什么?为什么会有热点?它们与临床相关吗?它们能告诉我们癌症是如何发展的吗?”
Alexandrov实验室的生物工程博士生、该研究的第一作者Erik Bergstrom说:“聚集性突变在很大程度上被忽视了,因为它们只占所有突变的很小一部分。但通过深入研究,我们发现它们在人类癌症的病因学中发挥着重要作用。”

聚集体细胞突变
该团队的发现是通过创建全面和详细的已知聚集体细胞突变的地图而实现的。他们首先绘制了2500多名癌症患者基因组中的所有突变(聚集突变和非聚集突变),这项工作总共包含了30种不同的癌症类型。研究人员使用亚历山德罗夫实验室开发的下一代人工智能方法绘制了他们的地图。该团队使用这些算法来检测个体患者中的聚集突变,并阐明导致这些事件的潜在突变过程。他们发现,在大约10%的人类癌症中,聚集的体细胞突变有助于癌症的进化。
更进一步,研究人员还发现,一些癌症驱动簇——特别是那些在已知的癌症驱动基因中发现的——可以用来预测患者的总体生存率。例如,BRAF基因(黑色素瘤中广泛观察的驱动基因)的聚集突变的存在,比非聚集突变的个体带来更好的总体患者生存。同时,EGFR基因(肺癌中广泛观察的驱动基因)的聚集突变的存在导致患者生存期的下降。
“重要的是,我们看到仅从这些基因中检测到的聚集突变就能产生不同的生存率,这是可以用临床常用的现有平台检测到的。因此,这是一个非常简单和精确的患者生存生物标记。”
“这项出色的工作强调了开发人工智能方法来阐明肿瘤生物学的重要性,以及使用可直接转化为临床视线的标准平台来发现和快速开发生物标志物的重要性。”摩尔斯癌症中心主任、加州大学圣地亚哥分校癌症研究和护理副校长Scott Lippman说。“这凸显了加州大学圣地亚哥分校在结合工程方法和人工智能解决当前癌症医学问题方面的优势。”
癌症进化的新模式
在这项研究中,研究人员还确定了导致聚集性体细胞突变的各种因素。这些因素包括紫外线辐射、饮酒、吸烟,值得注意的是,一种叫做APOBEC3的抗病毒酶的活性。
APOBEC3酶通常存在于细胞内部,作为细胞内部免疫反应的一部分。它们的主要工作是切断任何进入细胞的病毒。但在癌细胞中,研究人员认为APOBEC3酶可能弊大于利。
研究人员发现,癌细胞中通常充满了携带着已知癌症驱动基因的染色体外DNA (ecDNA)环状结构,在单个ecDNA分子中存在着聚集的突变。研究人员将这些突变归因于APOBEC3酶的活性。他们假设APOBEC3酶误将外链DNA的环当成外来病毒,并试图限制和切断它们。在此过程中,APOBEC3酶导致单个ecDNA分子内形成突变簇。这反过来又在加速癌症进化和可能导致耐药性方面发挥了关键作用。研究人员将这些聚集的突变环命名为kyklonas,这是希腊语中气旋的意思。
Alexandrov说:“这是一种全新的肿瘤发生模式。”他解释说,随着团队的其他发现,“这为新的治疗方法奠定了基础,临床医生可以考虑限制APOBEC3酶的活性和/或针对染色体外DNA的癌症治疗。”
参考资料:



