导语:近日,美国加州大学洛杉矶分校的研究人员发现记忆连接背后的关键分子机制,发现美国FDA批准的一款艾滋病药物可帮助中年小鼠恢复大脑功能,重拾往日记忆。
艾滋病与记忆衰退,看上去似乎是两类毫不相干的病症。然而,一项近期发表在Nature上题为“CCR5 closes the temporal window for memory linking”的研究发现,人类大脑记忆连接的缺失是由CCR5表达所导致的,而目前上市的一款艾滋病药物可以抑制大脑中CCR5的表达,从而恢复大脑记忆功能(图1)[1]。

图1 研究成果(图源:[1])
现实世界的记忆是在特定的背景下形成的,通常不是孤立地获得或回忆起来的,时间是记忆组织中的一个关键变量,因为时间相近的事件更可能有意义地联系在一起。因此,人类大脑习惯于将记忆存储成组,这样回忆起某个重要片段就会触发其他相关记忆。然而,随着年龄的增长,人类大脑会逐渐丧失连接相关记忆的能力。
那么,大脑中记忆连接丧失的幕后机制是什么?加州大学洛杉矶分校的研究团队发现,其或与CCR5基因的表达密切相关。其实对于CCR5,科学家早已不陌生。早在20多年前,就有研究发现,HIV(Human immunodeficiency virus)入侵人体细胞时靶向的正是CCR5受体。
此后,针对CCR5开发的艾滋病药物逐渐涌入市场并得到广泛应用,但CCR5的生理功能还远不止此。2016年12月, Tawnie Silva曾在elife上发表题为“CCR5 is a suppressor for cortical plasticity and hippocampal learning and memory”的研究,证实CCR5的表达会阻止机体唤起相关记忆,这可能也解释了为何艾滋病患者会出现认知缺陷(图2)[2]。

图2 研究成果(图源:[2])
通过小鼠实验,研究团队进一步发现CCR5表达的增加会阻止记忆连接。研究人员将小鼠间隔一段时间,分别放在两个环境不同的笼子中,并用微型显微镜观察神经元的活动以评估其大脑的记忆能力。试验显示:
★ 当间隔时间不长时,小鼠在两个环境中具有相似的活跃神经元,这表明小鼠可以将这两个环境的记忆联系起来;
★ 但当隔离间隔超12-24小时时,研究人员发现CCR5的表达量激增会导致原本活跃的神经元发生变化,记忆连接也会相应丧失。
随后,当研究人员敲除小鼠体内的CCR5基因时,小鼠又可以将无法连接的记忆联系起来(图3),这项研究揭示了CCR5表达在记忆连接中的关键作用。
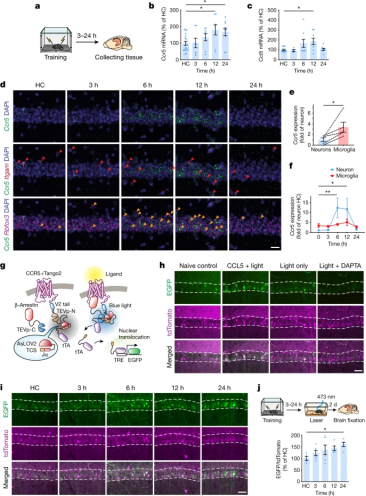
图3 CCR5促进了与年龄相关的记忆连接衰退,而CCR5拮抗剂逆转这一过程(图源:[1])
那么,既然涉及同一种受体,靶向CCR5的抗艾滋病药物能否直接用来提升记忆连接呢?为了验证该假设,研究团队测试了一种早已在2007年通过FDA批准上市的抗艾滋病感染药物Selzentry在小鼠中的功效(图4),研究结果显示此种药物可起到与敲除CCR5相同的效果,帮助小鼠逆转中年记忆丧失,再次连接记忆,逆转HIV感染引起的认知缺陷。

图4 抗艾滋病感染药物Selzentry(图源:辉瑞官网)
Selzentry由ViiV Healthcare公司制造,于2007年8月获得FDA批准上市。Selzentry是一种主要活性成分为Maraviroc的HIV-1处方药,与其他抗逆转录病毒药物一起使用,用于治疗2岁及以上,体重10公斤以上的趋化CCR5型HIV-1感染。在美国,它的商品名为Selzentry,而在其他国家和地区,其商品名为Celsentri。
该项研究提出了一种加强中年人记忆的新方法,有望对痴呆症进行尽早干预。研究人员下一步将组织以早期干预为目标的临床试验,测试Maraviroc对早期记忆丧失的恢复作用。
参考资料:
[1]Shen Y, Zhou M, Cai D, et al. CCR5 closes the temporal window for memory linking. Nature. 2022 May 25. doi: 10.1038/s41586-022-04783-1. Epub ahead of print. PMID: 35614219.
[2]Zhou M, Greenhill S, Huang S, et al. CCR5 is a suppressor for cortical plasticity and hippocampal learning and memory. Elife. 2016 Dec 20;5:e20985. doi: 10.7554/eLife.20985. PMID: 27996938; PMCID: PMC5213777.
[2]Zhou M, Greenhill S, Huang S, et al. CCR5 is a suppressor for cortical plasticity and hippocampal learning and memory. Elife. 2016 Dec 20;5:e20985. doi: 10.7554/eLife.20985. PMID: 27996938; PMCID: PMC5213777.
导语:近日,美国加州大学洛杉矶分校的研究人员发现记忆连接背后的关键分子机制,发现美国FDA批准的一款艾滋病药物可帮助中年小鼠恢复大脑功能,重拾往日记忆。
艾滋病与记忆衰退,看上去似乎是两类毫不相干的病症。然而,一项近期发表在Nature上题为“CCR5 closes the temporal window for memory linking”的研究发现,人类大脑记忆连接的缺失是由CCR5表达所导致的,而目前上市的一款艾滋病药物可以抑制大脑中CCR5的表达,从而恢复大脑记忆功能(图1)[1]。

图1 研究成果(图源:[1])
现实世界的记忆是在特定的背景下形成的,通常不是孤立地获得或回忆起来的,时间是记忆组织中的一个关键变量,因为时间相近的事件更可能有意义地联系在一起。因此,人类大脑习惯于将记忆存储成组,这样回忆起某个重要片段就会触发其他相关记忆。然而,随着年龄的增长,人类大脑会逐渐丧失连接相关记忆的能力。
那么,大脑中记忆连接丧失的幕后机制是什么?加州大学洛杉矶分校的研究团队发现,其或与CCR5基因的表达密切相关。其实对于CCR5,科学家早已不陌生。早在20多年前,就有研究发现,HIV(Human immunodeficiency virus)入侵人体细胞时靶向的正是CCR5受体。
此后,针对CCR5开发的艾滋病药物逐渐涌入市场并得到广泛应用,但CCR5的生理功能还远不止此。2016年12月, Tawnie Silva曾在elife上发表题为“CCR5 is a suppressor for cortical plasticity and hippocampal learning and memory”的研究,证实CCR5的表达会阻止机体唤起相关记忆,这可能也解释了为何艾滋病患者会出现认知缺陷(图2)[2]。

图2 研究成果(图源:[2])
通过小鼠实验,研究团队进一步发现CCR5表达的增加会阻止记忆连接。研究人员将小鼠间隔一段时间,分别放在两个环境不同的笼子中,并用微型显微镜观察神经元的活动以评估其大脑的记忆能力。试验显示:
★ 当间隔时间不长时,小鼠在两个环境中具有相似的活跃神经元,这表明小鼠可以将这两个环境的记忆联系起来;
★ 但当隔离间隔超12-24小时时,研究人员发现CCR5的表达量激增会导致原本活跃的神经元发生变化,记忆连接也会相应丧失。
随后,当研究人员敲除小鼠体内的CCR5基因时,小鼠又可以将无法连接的记忆联系起来(图3),这项研究揭示了CCR5表达在记忆连接中的关键作用。

图3 CCR5促进了与年龄相关的记忆连接衰退,而CCR5拮抗剂逆转这一过程(图源:[1])
那么,既然涉及同一种受体,靶向CCR5的抗艾滋病药物能否直接用来提升记忆连接呢?为了验证该假设,研究团队测试了一种早已在2007年通过FDA批准上市的抗艾滋病感染药物Selzentry在小鼠中的功效(图4),研究结果显示此种药物可起到与敲除CCR5相同的效果,帮助小鼠逆转中年记忆丧失,再次连接记忆,逆转HIV感染引起的认知缺陷。

图4 抗艾滋病感染药物Selzentry(图源:辉瑞官网)
Selzentry由ViiV Healthcare公司制造,于2007年8月获得FDA批准上市。Selzentry是一种主要活性成分为Maraviroc的HIV-1处方药,与其他抗逆转录病毒药物一起使用,用于治疗2岁及以上,体重10公斤以上的趋化CCR5型HIV-1感染。在美国,它的商品名为Selzentry,而在其他国家和地区,其商品名为Celsentri。
该项研究提出了一种加强中年人记忆的新方法,有望对痴呆症进行尽早干预。研究人员下一步将组织以早期干预为目标的临床试验,测试Maraviroc对早期记忆丧失的恢复作用。
参考资料:
[1]Shen Y, Zhou M, Cai D, et al. CCR5 closes the temporal window for memory linking. Nature. 2022 May 25. doi: 10.1038/s41586-022-04783-1. Epub ahead of print. PMID: 35614219.
[2]Zhou M, Greenhill S, Huang S, et al. CCR5 is a suppressor for cortical plasticity and hippocampal learning and memory. Elife. 2016 Dec 20;5:e20985. doi: 10.7554/eLife.20985. PMID: 27996938; PMCID: PMC5213777.
[2]Zhou M, Greenhill S, Huang S, et al. CCR5 is a suppressor for cortical plasticity and hippocampal learning and memory. Elife. 2016 Dec 20;5:e20985. doi: 10.7554/eLife.20985. PMID: 27996938; PMCID: PMC5213777.



