摘要:通过化学设计和合成,科学家们将获得诺贝尔奖的技术与治疗技术结合在一起,克服了CRISPR的一个关键限制。具体来说,这项突破性的工作提供了一种系统,可以为生成名为CRISPR-Cas9的基因编辑机器提供所需的数据。
美国西北大学的一组研究人员设计了一种新的基因编辑平台,它可以为未来基于crispr的近乎无限的治疗方法的应用提供信息。
通过化学设计和合成,该团队将获得诺贝尔奖的技术与他们自己实验室诞生的治疗技术结合在一起,克服了CRISPR的一个关键限制。具体来说,这项突破性的工作提供了一种系统,可以为生成名为CRISPR-Cas9的基因编辑机器提供所需的数据。该团队开发了一种将Cas-9蛋白转化为球形核酸(SNA)的方法,并将所需的关键成分装入其中,以访问广泛的组织和细胞类型,以及基因编辑所需的细胞内分隔室。
这项研究发表在《美国化学学会杂志》上的一篇题为“CRISPR Spherical Nucleic Acids”的论文中,展示了CRISPR SNAs如何在保持生物活性和基因编辑能力的同时穿过细胞膜进入细胞核。
图1 将Cas-9蛋白转化为球形核酸(SNA)的方法(图源:[1])
这项工作建立在由纳米技术先驱Chad a . Mirkin领导的25年努力的基础上,他发现了SNAs的特性,以及将它们与著名的线性表兄弟(生命蓝图)区别开来的因素。米尔金因发明了SNAs而闻名,这种结构通常由密集覆盖着DNA或RNA的球形纳米颗粒组成,赋予它们与自然界中发现的核酸形式截然不同的化学和物理特性。
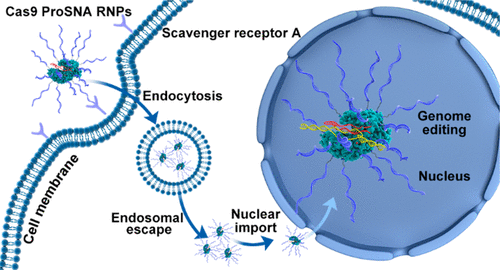
图2 Cas9 ProSNA RNPs(图源:[1])
米尔金是西北大学温伯格文理学院的乔治·b·拉斯曼化学教授,也是国际纳米技术研究所的主任。米尔金还是麦考密克工程学院化学与生物工程、生物医学工程和材料科学与工程的教授,也是西北大学范伯格医学院的医学教授。
SNAs有许多种类,其核心和外壳的化学成分和大小不同。目前,SNAs正在六项人类临床试验中被评估为有效的治疗药物,其中包括治疗多形胶质母细胞瘤(脑癌)和多种皮肤癌等衰弱疾病的试验。
Mirkin说:“这些新颖的纳米结构为研究人员提供了一条途径,通过大幅增加CRISPR机器可以传递到的细胞和组织类型,来拓宽CRISPR的用途范围。”“我们已经知道sna提供了进入皮肤、大脑、眼睛、免疫系统、胃肠道、心脏和肺的特权。当这种途径与过去四分之一世纪生物医学最重要的创新之一相结合时,好事就会随之而来。”
在目前的研究中,Mirkin的团队使用了基因编辑所需的Cas9蛋白质作为结构的核心,并将DNA链附着在其表面,从而制造出一种新型SNA。此外,这些SNAs预先装载了能够进行基因编辑的RNA,并与多肽融合,以控制它们在细胞隔层屏障中导航的能力,从而最大化效率。这些SNAs,像其他种类的SNAs一样,在不使用转染剂(通常需要将遗传物质传递到细胞中)的情况下有效地进入细胞,并在一些人类和小鼠细胞系中表现出高达32% - 47%的基因编辑效率。

图3 基因工程Cas9蛋白GALA内切酶N-端肽结合的方案设计(图源:[1])
该研究团队包括研究生研究员黄驰、韩振宇(Henry)和Michael Evangelopoulos。他们的研究得到了美国国立卫生研究院国家癌症研究所、谢尔曼·费尔柴尔德基金会、约翰·n·尼克尔森博士奖学金和亚历山大·s·奥纳西斯公益基金会的支持。
参考资料:
[1] Chi Huang, Zhenyu Han, Michael Evangelopoulos, Chad A. Mirkin. CRISPR Spherical Nucleic Acids. Journal of the American Chemical Society, 2022; DOI: 10.1021/jacs.2c07913
摘要:通过化学设计和合成,科学家们将获得诺贝尔奖的技术与治疗技术结合在一起,克服了CRISPR的一个关键限制。具体来说,这项突破性的工作提供了一种系统,可以为生成名为CRISPR-Cas9的基因编辑机器提供所需的数据。
美国西北大学的一组研究人员设计了一种新的基因编辑平台,它可以为未来基于crispr的近乎无限的治疗方法的应用提供信息。
通过化学设计和合成,该团队将获得诺贝尔奖的技术与他们自己实验室诞生的治疗技术结合在一起,克服了CRISPR的一个关键限制。具体来说,这项突破性的工作提供了一种系统,可以为生成名为CRISPR-Cas9的基因编辑机器提供所需的数据。该团队开发了一种将Cas-9蛋白转化为球形核酸(SNA)的方法,并将所需的关键成分装入其中,以访问广泛的组织和细胞类型,以及基因编辑所需的细胞内分隔室。
这项研究发表在《美国化学学会杂志》上的一篇题为“CRISPR Spherical Nucleic Acids”的论文中,展示了CRISPR SNAs如何在保持生物活性和基因编辑能力的同时穿过细胞膜进入细胞核。

图1 将Cas-9蛋白转化为球形核酸(SNA)的方法(图源:[1])
这项工作建立在由纳米技术先驱Chad a . Mirkin领导的25年努力的基础上,他发现了SNAs的特性,以及将它们与著名的线性表兄弟(生命蓝图)区别开来的因素。米尔金因发明了SNAs而闻名,这种结构通常由密集覆盖着DNA或RNA的球形纳米颗粒组成,赋予它们与自然界中发现的核酸形式截然不同的化学和物理特性。

图2 Cas9 ProSNA RNPs(图源:[1])
米尔金是西北大学温伯格文理学院的乔治·b·拉斯曼化学教授,也是国际纳米技术研究所的主任。米尔金还是麦考密克工程学院化学与生物工程、生物医学工程和材料科学与工程的教授,也是西北大学范伯格医学院的医学教授。
SNAs有许多种类,其核心和外壳的化学成分和大小不同。目前,SNAs正在六项人类临床试验中被评估为有效的治疗药物,其中包括治疗多形胶质母细胞瘤(脑癌)和多种皮肤癌等衰弱疾病的试验。
Mirkin说:“这些新颖的纳米结构为研究人员提供了一条途径,通过大幅增加CRISPR机器可以传递到的细胞和组织类型,来拓宽CRISPR的用途范围。”“我们已经知道sna提供了进入皮肤、大脑、眼睛、免疫系统、胃肠道、心脏和肺的特权。当这种途径与过去四分之一世纪生物医学最重要的创新之一相结合时,好事就会随之而来。”
在目前的研究中,Mirkin的团队使用了基因编辑所需的Cas9蛋白质作为结构的核心,并将DNA链附着在其表面,从而制造出一种新型SNA。此外,这些SNAs预先装载了能够进行基因编辑的RNA,并与多肽融合,以控制它们在细胞隔层屏障中导航的能力,从而最大化效率。这些SNAs,像其他种类的SNAs一样,在不使用转染剂(通常需要将遗传物质传递到细胞中)的情况下有效地进入细胞,并在一些人类和小鼠细胞系中表现出高达32% - 47%的基因编辑效率。

图3 基因工程Cas9蛋白GALA内切酶N-端肽结合的方案设计(图源:[1])
该研究团队包括研究生研究员黄驰、韩振宇(Henry)和Michael Evangelopoulos。他们的研究得到了美国国立卫生研究院国家癌症研究所、谢尔曼·费尔柴尔德基金会、约翰·n·尼克尔森博士奖学金和亚历山大·s·奥纳西斯公益基金会的支持。
参考资料:
[1] Chi Huang, Zhenyu Han, Michael Evangelopoulos, Chad A. Mirkin. CRISPR Spherical Nucleic Acids. Journal of the American Chemical Society, 2022; DOI: 10.1021/jacs.2c07913



