摘要:哈佛大学威斯生物激励工程研究所的一项新进展克服了目前在空间转录组学方面的局限性,采用了一种名为“Light-Seq”的DNA纳米技术驱动方法。Light-Seq允许研究人员用专属于少数感兴趣细胞的独特DNA条形码对全部RNA序列进行“地理标记”。
在显微镜下,研究人员经常观察到不同类型的细胞在组织中以独特的模式自我组织,或者有时一种罕见的细胞类型通过占据独特的位置、显示出不寻常的形状或表达特定的生物标记分子而脱颖而出。为了确定他们观察到的更深层次的意义,他们开发了一种方法,通过分析细胞中存在的基因来源的RNA分子来访问细胞的基因表达模式(转录组),他们可以将其与细胞的形状、空间位置和分子生物标记进行匹配。
然而,这些“空间转录组学”方法仍然只能捕获细胞总RNA分子的一小部分,不能提供单细胞测序方法提供的深度和质量分析,单细胞测序方法是为了研究从组织或生物液体中分离出来的单个细胞的转录组而开发的通过下一代测序(NGS)技术。它们也不允许研究人员仅根据细胞在组织中的位置锁定特定细胞,这将极大地促进研究分离的细胞群,或罕见的、难以分离的细胞,如具有独特功能的罕见脑细胞,或入侵肿瘤的免疫细胞。此外,由于原始组织环境被破坏,许多空间转录组学和所有单细胞测序方法使研究人员无法重新访问样本进行后续分析,而且这些方法需要专门的仪器或试剂,因此成本很高。
哈佛大学威斯生物激励工程研究所的一项新进展通过一种名为“Light- seq”的DNA纳米技术驱动方法克服了这些限制。Light-Seq允许研究人员用专属于少数感兴趣细胞的独特DNA条形码对全部RNA序列进行“地理标记”。这些靶细胞在显微镜下通过一个快速有效的光交联过程被选择。

图1 Light-Seq允许用专属于少数细胞的独特DNA条形码对全部RNA序列进行标记(图源:[1])
在一种新的DNA纳米技术的帮助下,条形码RNA序列被翻译成连贯的DNA链,然后可以从组织样本中收集并使用NGS进行识别。Light-Seq过程可以在相同的样本中对不同的细胞群使用不同的条形码进行重复,并保留原样以供后续分析。它的性能可与单细胞测序方法相媲美,极大地拓宽了组织样本调查的深度和范围。
通讯作者之一、怀斯研究所核心成员Peng Yin博士说:“Light-Seq独特的功能组合填补了未满足的需求:对保存的组织中难以分离的细胞群或罕见细胞类型进行图像信息、空间规定、深度测序分析的能力,与它们高度细化的基因表达状态与空间、形态和潜在疾病相关特征的一一对应,因此,它有潜力快速推进生物医学研究领域的生物发现过程。”
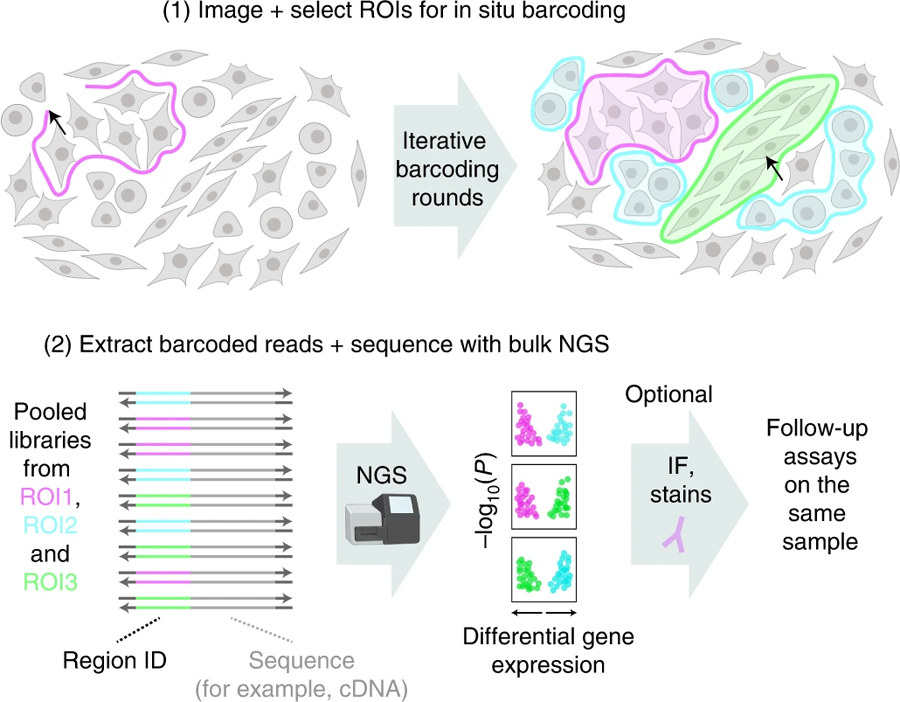
图2 Light Seq支持对选定的细胞或组织区域原位进行选择性条码用于转录组测序(图源:[1])
从原位条码到异位测序
Light-Seq项目是由Yin在Wyss的小组中的Jocelyn (Josie) Kishi博士、Sinem Saka博士和Ninning Liu博士以及Constance Cepko在HMS的实验室中的Emma West博士带头发起的。
在此之前,Kishi和Saka已经开发了SABER-FISH,作为一种空间转录组学方法,直接在完整的组织中(原位)对基因表达进行成像。"有了SABER-FISH,我们离捕获细胞的完整基因表达程序仍有几个数量级的距离,每个细胞有成千上万的不同的RNA分子。RNA分子过于密集,无法用目前的成像技术完整地捕获它们,"共同第一作者和共同通讯作者Kishi说。"Light-Seq通过将高分辨率的条形码标记与通过NGS进行的全转录组测序结合起来解决了这个问题,使我们获得了两个世界的最好结果和额外的关键优势。" 在进行这项研究时,Kishi是Yin团队中的一名Wyss技术发展研究员,现在正与她的一些合著者一起追求Light-Seq的商业化道路。
“为了在完整组织样本的定制选择位置对细胞进行特定测序,我们开发了一种新的方法,将DNA条形码光交联到RNA分子的副本上,以及一种DNA纳米技术驱动的程序,使它们及其附加的RNA序列可被NGS读取。”共同第一作者Liu说,他是Yin团队的博士后,之前曾与人合作开发了一个名为“Action-PAINT”的超分辨率成像方法的并行DNA条形码平台,该平台也成为了Light-Seq的核心组件之一。
首先,DNA引物与细胞中的RNA分子“碱基对”,并被扩展以创建称为互补DNA序列(cdna)的RNA序列副本。然后,含有超快光交联子核苷酸的DNA条形码链依次与细胞中的cdna进行碱基配对。当靶细胞在显微镜下通过一种类似模板的光学装置被照亮时,这些细胞就会永久连接在一起,这种光学装置将显微镜下的其他非靶细胞置于黑暗中,从而使它们免受光交联反应的影响。在洗掉那些没有永久连接的细胞中的条形码DNA序列之后原位,这个过程可以用不同的条形码和光线模式重复,以标记更多感兴趣的区域。
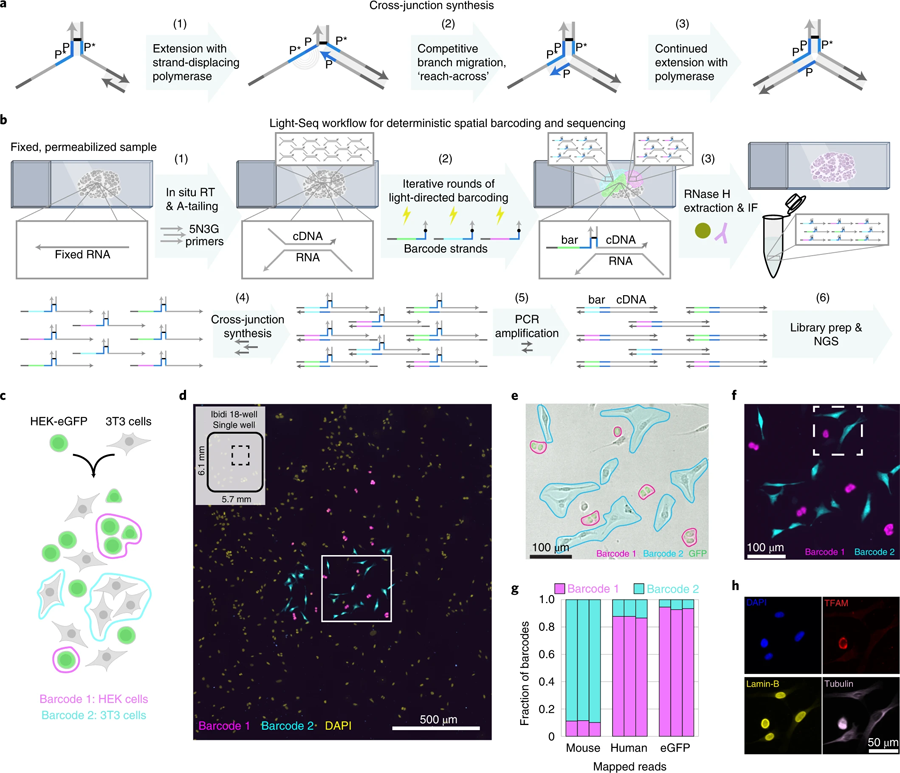
图3 交联合成和结合细胞混合物验证的全原位协议。(图源:[1])
“为了能够将这种条形码工作流程与NGS集成,我们设计了一种基于DNA纳米技术的新的拼接反应。这项创新使我们能够将我们的条形码cdna转换成连续的读出序列。然后我们可以从样本中提取含有条形码的cDNA序列的完整集合,并用标准的NGS技术分析它们,最终,每个条形码都将完整的转录组读数追溯到组织样本中预先选择的细胞,这些细胞保持完整,以供后续分析。这为我们提供了一个独特的机会,在测序验证或进一步探索后重新访问完全相同的细胞。
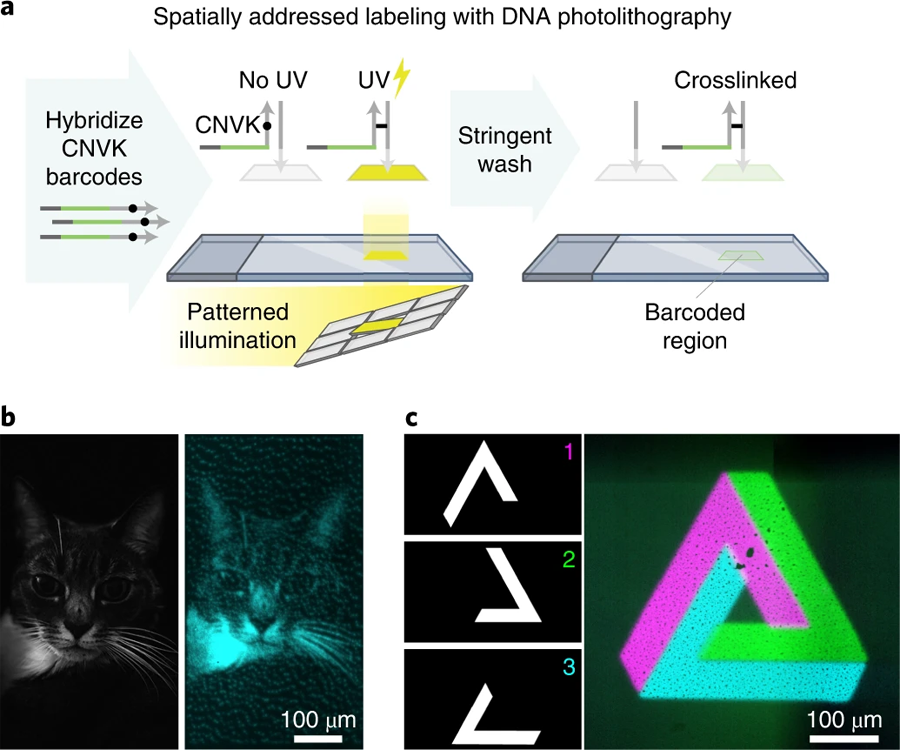
图4 通过DNA光交联进行空间定位标记(图源:[1])
a 生物素标记的单链DNA寡核苷酸通过生物素-链霉亲和素结合固定在玻璃表面。
观察复杂组织和稀有细胞
随着Light-Seq在培养细胞中的首次验证,Yin的团队想要将其应用到复杂的组织中,并与HMS的Constance Cepko博士团队合作。Cepko是该研究的通讯作者之一,他研究了视网膜作为神经系统模型的发展。Kishi, Saka和Liu与Cepko团队的West合作,将Light-Seq应用于小鼠视网膜的横截面,并分析具有不同功能的三个主要层。研究人员达到了与单细胞测序方法相当的序列覆盖范围,并发现视网膜的三个主要层之间富集了数千个rna。他们还表明,在序列提取后,组织样本保持完整,并可以进一步成像的蛋白质和其他生物分子。
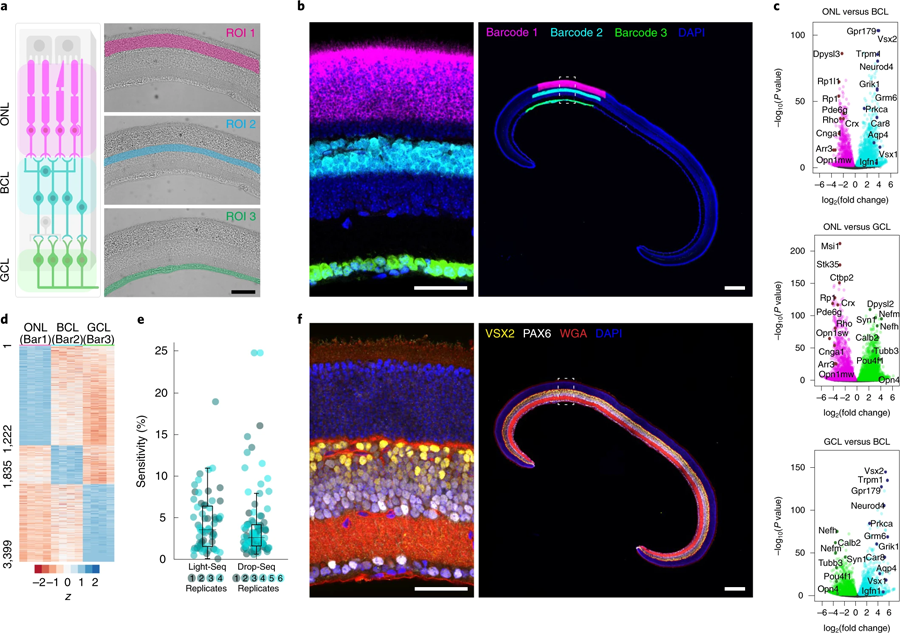
图5 Light Seq技术应用于小鼠冷冻视网膜固定区域的三个主要视网膜层的空间条码编码。(图源:[1])
West说:“将Light-Seq发挥到极致,我们能够分离出一种非常罕见的细胞类型的完整转录组,这种细胞被称为‘多巴胺能无分泌细胞’(dac),由于它与视网膜中其他细胞的复杂连接,很难分离,每个横截面只提取4到8个独立的条形码细胞。”dac参与调节眼睛的昼夜节律,通过微调昼夜周期中不同光照的视觉感知。West补充说:“Light-Seq还检测到在低水平下特异表达在dac中的rna,以及几十种dac特异性的生物标志物rna,据我们所知,这为研究这种罕见的细胞类型打开了新的机会。”West在进行这项研究时是Cepko的研究生,然后是博士后,现在已经加入了Kishi的Light-Seq商业化努力。
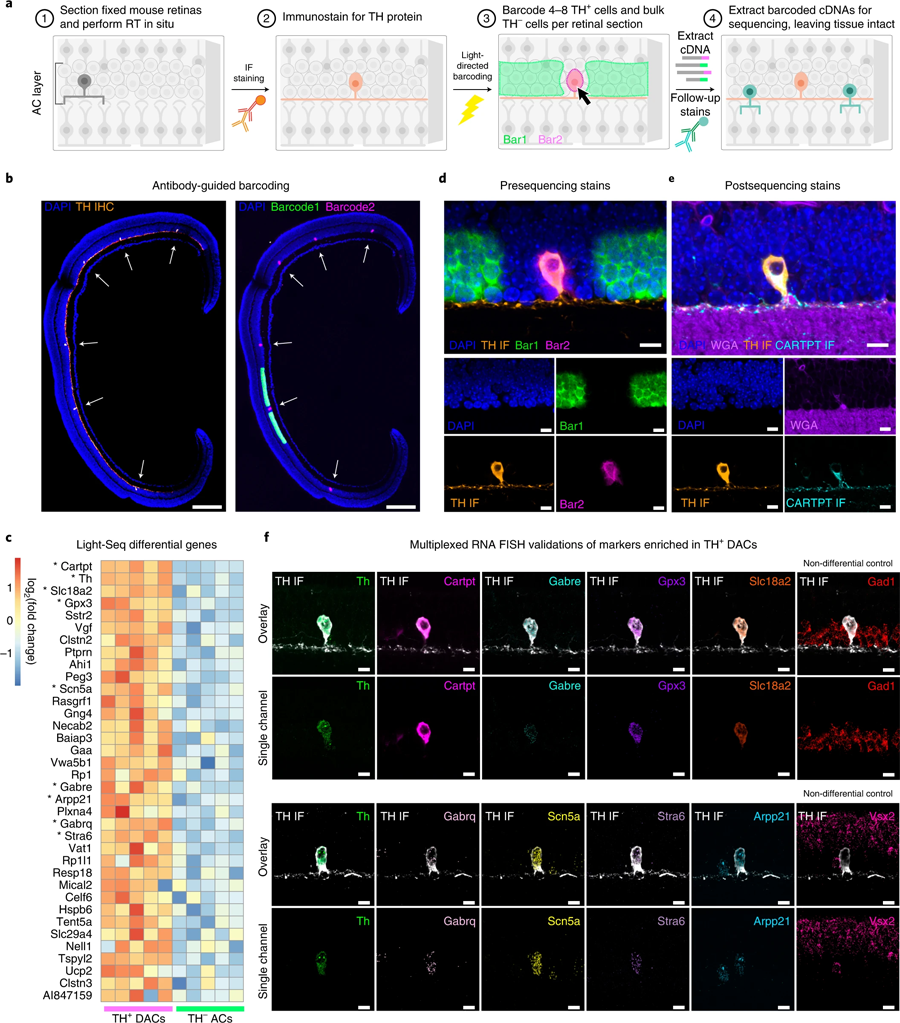
图6 Light Seq用于稀有细胞转录组学(图源:[1])
将空间转录组学领域向NGS开放,也增加了单个RNA物种水平的信息。“我们的测序数据清楚地表明,Light-Seq可以确定rna结构的自然变化。展望未来,我们对使用Light-Seq更好地了解免疫系统、疾病传播细胞和不同治疗策略(如基因和细胞治疗)之间的相互作用非常感兴趣。”Kishi说。
“由Peng Yin的团队在Wyss研究所的分子机器人计划中开发的Light-Seq技术再次表明,追求完全非传统的方法和利用合成生物学可以导致一种具有巨大潜力的颠覆性技术,促进基础研究和临床医学的发展。”
参考资料:
[1] Light-Seq: Light-directed in situ barcoding of biomolecules in fixed cells and tissues for spatially indexed sequencing
摘要:哈佛大学威斯生物激励工程研究所的一项新进展克服了目前在空间转录组学方面的局限性,采用了一种名为“Light-Seq”的DNA纳米技术驱动方法。Light-Seq允许研究人员用专属于少数感兴趣细胞的独特DNA条形码对全部RNA序列进行“地理标记”。
在显微镜下,研究人员经常观察到不同类型的细胞在组织中以独特的模式自我组织,或者有时一种罕见的细胞类型通过占据独特的位置、显示出不寻常的形状或表达特定的生物标记分子而脱颖而出。为了确定他们观察到的更深层次的意义,他们开发了一种方法,通过分析细胞中存在的基因来源的RNA分子来访问细胞的基因表达模式(转录组),他们可以将其与细胞的形状、空间位置和分子生物标记进行匹配。
然而,这些“空间转录组学”方法仍然只能捕获细胞总RNA分子的一小部分,不能提供单细胞测序方法提供的深度和质量分析,单细胞测序方法是为了研究从组织或生物液体中分离出来的单个细胞的转录组而开发的通过下一代测序(NGS)技术。它们也不允许研究人员仅根据细胞在组织中的位置锁定特定细胞,这将极大地促进研究分离的细胞群,或罕见的、难以分离的细胞,如具有独特功能的罕见脑细胞,或入侵肿瘤的免疫细胞。此外,由于原始组织环境被破坏,许多空间转录组学和所有单细胞测序方法使研究人员无法重新访问样本进行后续分析,而且这些方法需要专门的仪器或试剂,因此成本很高。
哈佛大学威斯生物激励工程研究所的一项新进展通过一种名为“Light- seq”的DNA纳米技术驱动方法克服了这些限制。Light-Seq允许研究人员用专属于少数感兴趣细胞的独特DNA条形码对全部RNA序列进行“地理标记”。这些靶细胞在显微镜下通过一个快速有效的光交联过程被选择。

图1 Light-Seq允许用专属于少数细胞的独特DNA条形码对全部RNA序列进行标记(图源:[1])
在一种新的DNA纳米技术的帮助下,条形码RNA序列被翻译成连贯的DNA链,然后可以从组织样本中收集并使用NGS进行识别。Light-Seq过程可以在相同的样本中对不同的细胞群使用不同的条形码进行重复,并保留原样以供后续分析。它的性能可与单细胞测序方法相媲美,极大地拓宽了组织样本调查的深度和范围。
通讯作者之一、怀斯研究所核心成员Peng Yin博士说:“Light-Seq独特的功能组合填补了未满足的需求:对保存的组织中难以分离的细胞群或罕见细胞类型进行图像信息、空间规定、深度测序分析的能力,与它们高度细化的基因表达状态与空间、形态和潜在疾病相关特征的一一对应,因此,它有潜力快速推进生物医学研究领域的生物发现过程。”

图2 Light Seq支持对选定的细胞或组织区域原位进行选择性条码用于转录组测序(图源:[1])
从原位条码到异位测序
Light-Seq项目是由Yin在Wyss的小组中的Jocelyn (Josie) Kishi博士、Sinem Saka博士和Ninning Liu博士以及Constance Cepko在HMS的实验室中的Emma West博士带头发起的。
在此之前,Kishi和Saka已经开发了SABER-FISH,作为一种空间转录组学方法,直接在完整的组织中(原位)对基因表达进行成像。"有了SABER-FISH,我们离捕获细胞的完整基因表达程序仍有几个数量级的距离,每个细胞有成千上万的不同的RNA分子。RNA分子过于密集,无法用目前的成像技术完整地捕获它们,"共同第一作者和共同通讯作者Kishi说。"Light-Seq通过将高分辨率的条形码标记与通过NGS进行的全转录组测序结合起来解决了这个问题,使我们获得了两个世界的最好结果和额外的关键优势。" 在进行这项研究时,Kishi是Yin团队中的一名Wyss技术发展研究员,现在正与她的一些合著者一起追求Light-Seq的商业化道路。
“为了在完整组织样本的定制选择位置对细胞进行特定测序,我们开发了一种新的方法,将DNA条形码光交联到RNA分子的副本上,以及一种DNA纳米技术驱动的程序,使它们及其附加的RNA序列可被NGS读取。”共同第一作者Liu说,他是Yin团队的博士后,之前曾与人合作开发了一个名为“Action-PAINT”的超分辨率成像方法的并行DNA条形码平台,该平台也成为了Light-Seq的核心组件之一。
首先,DNA引物与细胞中的RNA分子“碱基对”,并被扩展以创建称为互补DNA序列(cdna)的RNA序列副本。然后,含有超快光交联子核苷酸的DNA条形码链依次与细胞中的cdna进行碱基配对。当靶细胞在显微镜下通过一种类似模板的光学装置被照亮时,这些细胞就会永久连接在一起,这种光学装置将显微镜下的其他非靶细胞置于黑暗中,从而使它们免受光交联反应的影响。在洗掉那些没有永久连接的细胞中的条形码DNA序列之后原位,这个过程可以用不同的条形码和光线模式重复,以标记更多感兴趣的区域。

图3 交联合成和结合细胞混合物验证的全原位协议。(图源:[1])
“为了能够将这种条形码工作流程与NGS集成,我们设计了一种基于DNA纳米技术的新的拼接反应。这项创新使我们能够将我们的条形码cdna转换成连续的读出序列。然后我们可以从样本中提取含有条形码的cDNA序列的完整集合,并用标准的NGS技术分析它们,最终,每个条形码都将完整的转录组读数追溯到组织样本中预先选择的细胞,这些细胞保持完整,以供后续分析。这为我们提供了一个独特的机会,在测序验证或进一步探索后重新访问完全相同的细胞。

图4 通过DNA光交联进行空间定位标记(图源:[1])
a 生物素标记的单链DNA寡核苷酸通过生物素-链霉亲和素结合固定在玻璃表面。
观察复杂组织和稀有细胞
随着Light-Seq在培养细胞中的首次验证,Yin的团队想要将其应用到复杂的组织中,并与HMS的Constance Cepko博士团队合作。Cepko是该研究的通讯作者之一,他研究了视网膜作为神经系统模型的发展。Kishi, Saka和Liu与Cepko团队的West合作,将Light-Seq应用于小鼠视网膜的横截面,并分析具有不同功能的三个主要层。研究人员达到了与单细胞测序方法相当的序列覆盖范围,并发现视网膜的三个主要层之间富集了数千个rna。他们还表明,在序列提取后,组织样本保持完整,并可以进一步成像的蛋白质和其他生物分子。

图5 Light Seq技术应用于小鼠冷冻视网膜固定区域的三个主要视网膜层的空间条码编码。(图源:[1])
West说:“将Light-Seq发挥到极致,我们能够分离出一种非常罕见的细胞类型的完整转录组,这种细胞被称为‘多巴胺能无分泌细胞’(dac),由于它与视网膜中其他细胞的复杂连接,很难分离,每个横截面只提取4到8个独立的条形码细胞。”dac参与调节眼睛的昼夜节律,通过微调昼夜周期中不同光照的视觉感知。West补充说:“Light-Seq还检测到在低水平下特异表达在dac中的rna,以及几十种dac特异性的生物标志物rna,据我们所知,这为研究这种罕见的细胞类型打开了新的机会。”West在进行这项研究时是Cepko的研究生,然后是博士后,现在已经加入了Kishi的Light-Seq商业化努力。

图6 Light Seq用于稀有细胞转录组学(图源:[1])
将空间转录组学领域向NGS开放,也增加了单个RNA物种水平的信息。“我们的测序数据清楚地表明,Light-Seq可以确定rna结构的自然变化。展望未来,我们对使用Light-Seq更好地了解免疫系统、疾病传播细胞和不同治疗策略(如基因和细胞治疗)之间的相互作用非常感兴趣。”Kishi说。
“由Peng Yin的团队在Wyss研究所的分子机器人计划中开发的Light-Seq技术再次表明,追求完全非传统的方法和利用合成生物学可以导致一种具有巨大潜力的颠覆性技术,促进基础研究和临床医学的发展。”
参考资料:
[1] Light-Seq: Light-directed in situ barcoding of biomolecules in fixed cells and tissues for spatially indexed sequencing



