摘要:来自弗莱堡和哈佛大学的研究人员发表了B细胞抗原受体的三维结构,对其组成有了新的认识。
B细胞表面覆盖着抗原受体,它们用它来识别入侵的病原体,如细菌和病毒。当B细胞受体与抗原结合时,即与外来结构结合时,B细胞被激活并引发抗体的产生。抗体对我们的生存至关重要,并保护我们免受COVID-19等病原体感染带来的严重疾病。疫苗具有保护作用,因为它们激活抗原受体,从而触发免疫反应。来自美国弗莱堡大学和哈佛医学院优秀CIBSS集群的一个国际研究团队现在发表了一种IgM型B细胞受体的确切分子结构。他们的发现表明,B细胞表面的受体与其他受体相互作用,从而控制其信号转导。这项研究发表在著名的《Nature》杂志上。

图1 国际研究团队发表了一种IgM型B细胞受体的确切分子结构(图源:[1])
信号亚基与免疫球蛋白的联系
B细胞抗原受体由一种结合在细胞膜上的抗体和两种较小的蛋白质Igα和Igβ组成。一旦B细胞受体识别出病原体,这些较小的亚基就会将信号传递到细胞内部。弗莱堡大学生物学院的Michael Reth教授博士说:“这些信号亚基究竟是如何与免疫球蛋白相连接的,这在以前是未知的。”Michael Reth教授已经对这种受体进行了30多年的研究,并最初发现了它的信号亚基。他是CIBSS综合生物信号研究中心卓越集群的成员,也是bbss卓越集群的联合主任。“在很长一段时间里,我们没有技术上的可能性来研究膜蛋白的确切结构。现在,低温电子显微镜使我们能够创建B细胞受体的高分辨率图像,”Reth说。
在冷冻电子显微镜下,要研究的样品被迅速冷却到零下183°C。这就减少了分子的自然运动,防止了微小冰晶的形成,否则会破坏蛋白质结构。通过这种方式,它可以达到比其他电子显微镜方法高许多倍的分辨率。在他们目前的研究中,研究人员实现了3.3 ångströms 的分辨率,这相当于几个原子的宽度。为此,他们将数十万张受体的完整图像与缺少两个灵活区域的截断版本的图像结合在一起。然后,他们利用这些数据在计算机上计算出B细胞受体的完整三维结构。
对称的膜结合抗体只在一侧结合
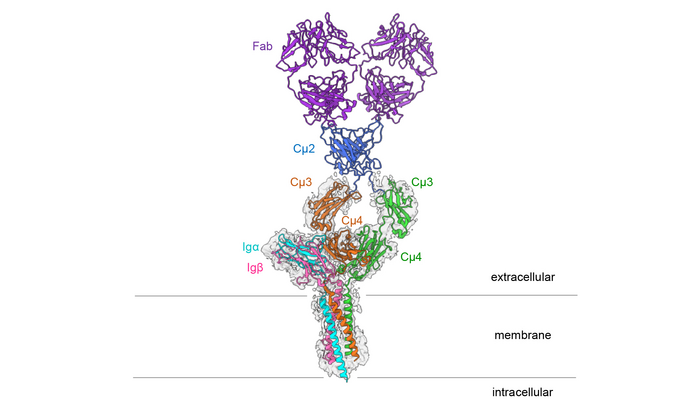
图2 小鼠IgM B细胞受体的结构
这种三维结构的惊人之处在于,这种对称的膜结合抗体只与一侧的Ig α和Ig β结合,因此形成了一个不对称的复合体。这种不对称类似于T细胞受体的不对称,T细胞受体是另一种重要的免疫受体,其结构于2019年首次阐明。Reth解释说:“这两种类型的抗原受体形成了不对称的复合物,这是令人震惊的。这使我们得出结论,现在阐明的结构是一个更大的受体复合体的一部分,它与B细胞表面的其他分子相互作用。”
这种更大的结构是通过较小的力量连接在一起的,还不能用冷冻电子显微镜等技术进行研究。然而,最新发表的分子结构为这种与其他分子的相互作用提供了进一步的证据:它表明B细胞受体的外部包含保守的氨基酸。如果氨基酸在进化过程中几乎不发生变化,因此在不同生物的抗原受体中是相同的,则被称为保守氨基酸。“向外定向的保守氨基酸的存在表明,IgM B细胞受体有进一步的结合伙伴,”Reth说。“换句话说,到目前为止,我们只知道机器的一部分,现在我们想要识别其他的组成部分,并确定它们是如何影响受体的信号传递效果的。”
这些其他的构建模块可以解释为什么受体通常保持静止,只有当它与抗原结合时才会被激活。“这将是适应性免疫研究的下一个重要任务之一,”Reth总结道。“更好地了解B细胞激活也可以帮助我们进一步改进疫苗的开发,或了解B细胞受体以不受控制的方式激活的淋巴瘤的形成。”
参考资料:
[1] Structural principles of B-cell antigen receptor assembly
摘要:来自弗莱堡和哈佛大学的研究人员发表了B细胞抗原受体的三维结构,对其组成有了新的认识。
B细胞表面覆盖着抗原受体,它们用它来识别入侵的病原体,如细菌和病毒。当B细胞受体与抗原结合时,即与外来结构结合时,B细胞被激活并引发抗体的产生。抗体对我们的生存至关重要,并保护我们免受COVID-19等病原体感染带来的严重疾病。疫苗具有保护作用,因为它们激活抗原受体,从而触发免疫反应。来自美国弗莱堡大学和哈佛医学院优秀CIBSS集群的一个国际研究团队现在发表了一种IgM型B细胞受体的确切分子结构。他们的发现表明,B细胞表面的受体与其他受体相互作用,从而控制其信号转导。这项研究发表在著名的《Nature》杂志上。

图1 国际研究团队发表了一种IgM型B细胞受体的确切分子结构(图源:[1])
信号亚基与免疫球蛋白的联系
B细胞抗原受体由一种结合在细胞膜上的抗体和两种较小的蛋白质Igα和Igβ组成。一旦B细胞受体识别出病原体,这些较小的亚基就会将信号传递到细胞内部。弗莱堡大学生物学院的Michael Reth教授博士说:“这些信号亚基究竟是如何与免疫球蛋白相连接的,这在以前是未知的。”Michael Reth教授已经对这种受体进行了30多年的研究,并最初发现了它的信号亚基。他是CIBSS综合生物信号研究中心卓越集群的成员,也是bbss卓越集群的联合主任。“在很长一段时间里,我们没有技术上的可能性来研究膜蛋白的确切结构。现在,低温电子显微镜使我们能够创建B细胞受体的高分辨率图像,”Reth说。
在冷冻电子显微镜下,要研究的样品被迅速冷却到零下183°C。这就减少了分子的自然运动,防止了微小冰晶的形成,否则会破坏蛋白质结构。通过这种方式,它可以达到比其他电子显微镜方法高许多倍的分辨率。在他们目前的研究中,研究人员实现了3.3 ångströms 的分辨率,这相当于几个原子的宽度。为此,他们将数十万张受体的完整图像与缺少两个灵活区域的截断版本的图像结合在一起。然后,他们利用这些数据在计算机上计算出B细胞受体的完整三维结构。
对称的膜结合抗体只在一侧结合

图2 小鼠IgM B细胞受体的结构
这种三维结构的惊人之处在于,这种对称的膜结合抗体只与一侧的Ig α和Ig β结合,因此形成了一个不对称的复合体。这种不对称类似于T细胞受体的不对称,T细胞受体是另一种重要的免疫受体,其结构于2019年首次阐明。Reth解释说:“这两种类型的抗原受体形成了不对称的复合物,这是令人震惊的。这使我们得出结论,现在阐明的结构是一个更大的受体复合体的一部分,它与B细胞表面的其他分子相互作用。”
这种更大的结构是通过较小的力量连接在一起的,还不能用冷冻电子显微镜等技术进行研究。然而,最新发表的分子结构为这种与其他分子的相互作用提供了进一步的证据:它表明B细胞受体的外部包含保守的氨基酸。如果氨基酸在进化过程中几乎不发生变化,因此在不同生物的抗原受体中是相同的,则被称为保守氨基酸。“向外定向的保守氨基酸的存在表明,IgM B细胞受体有进一步的结合伙伴,”Reth说。“换句话说,到目前为止,我们只知道机器的一部分,现在我们想要识别其他的组成部分,并确定它们是如何影响受体的信号传递效果的。”
这些其他的构建模块可以解释为什么受体通常保持静止,只有当它与抗原结合时才会被激活。“这将是适应性免疫研究的下一个重要任务之一,”Reth总结道。“更好地了解B细胞激活也可以帮助我们进一步改进疫苗的开发,或了解B细胞受体以不受控制的方式激活的淋巴瘤的形成。”
参考资料:
[1] Structural principles of B-cell antigen receptor assembly



