摘要:一项新的研究发现了一种蛋白质,这种蛋白质可以使黑色素瘤(最严重的皮肤癌类型)变得更具侵略性,因为它赋予癌细胞改变细胞核形状的能力——这种特征允许细胞在身体各处迁移和扩散。
伦敦玛丽女王大学、伦敦国王学院和弗朗西斯克里克研究所领导的研究发现了一种蛋白质,这种蛋白质通过赋予癌细胞改变细胞核形状的能力,使黑色素瘤(最严重的皮肤癌类型)更具攻击性,这种特征使细胞能够在全身迁移和扩散。
发表在《自然细胞生物学》杂志上的这项研究,模拟了侵袭性黑色素瘤细胞的行为,这种细胞能够改变细胞核的形状,克服癌细胞在组织中迁移时遇到的物理限制。研究发现,这些侵袭性黑素瘤细胞中含有一种叫做LAP1的蛋白质,这种蛋白质水平的升高与黑素瘤患者预后不良有关。

图1 研究发现LAP1蛋白质的升高与黑素瘤患者预后不良有关(图源:[1])
黑色素瘤是一种皮肤癌,可以扩散到身体的其他器官。癌症扩散或“转移”是癌症相关死亡的主要原因。虽然转移已被广泛研究,但其发生机制尚不清楚。这项研究的发现为黑色素瘤的发展机制提供了新的线索,并可能为开发针对黑色素瘤扩散的新方法铺平道路。
通过细胞核迁移
该研究由巴茨癌症研究所的Victoria Sanz-Moreno教授和伦敦国王学院及弗朗西斯-克里克研究所的Jeremy Carlton博士共同领导,主要由英国癌症研究中心、惠康基金会和巴茨慈善机构资助。
在这项研究中,研究小组在实验中挑战侵袭性和非侵袭性黑素瘤细胞,让它们通过比细胞核尺寸小的人造膜上的孔隙迁移。侵袭性细胞来自一名黑色素瘤患者的转移部位,而侵袭性较低的细胞来自同一名患者的原始或“原发性”黑色素瘤。
为了转移,癌细胞需要从原发肿瘤中分离出来,转移到身体的另一部分并在那里开始生长。然而,肿瘤周围的致密环境使癌细胞很难在物理上进行这种操作。
细胞包含一个大而坚硬的结构,称为细胞核,它存储细胞的遗传信息,但它也限制了细胞通过肿瘤环境中紧密间隙的能力。为了让癌细胞挤过这些缝隙,它们需要让细胞核更具延展性。
迁移实验后进行的成像显示,具有侵袭性的细胞能够比侵袭性较低的细胞更有效地通过孔隙,因为它们在细胞核边缘形成了称为“"blebs(核膜泡,生物通注)”的凸起。对黑色素瘤细胞的遗传分析显示,形成泡状物的侵袭性细胞含有更高水平的LAP1蛋白,这种蛋白位于围绕细胞核的膜(称为核膜)内。
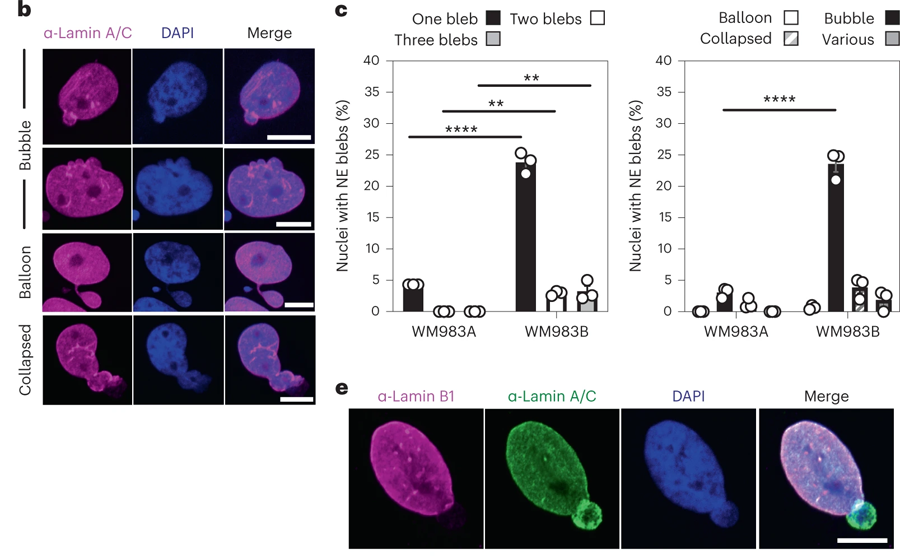
图2 转移性黑色素瘤细胞的NE(核包膜蛋白)是高度活跃的(图源:[1])
Jeremy Carlton博士的实验室对理解细胞内膜结合结构的动力学很感兴趣,他说:
“核膜被拴在下面的细胞核上,我们的研究表明,LAP1蛋白松开了这种束缚,使核膜隆起并形成气泡,使细胞核更流动。因此,癌细胞可以挤过通常会阻止它们的缝隙。”
当研究小组在实验中阻断了侵袭性细胞中LAP1蛋白的产生,然后再让癌细胞通过小孔时,他们发现细胞形成核膜泡的能力较弱,也较难挤过这些空隙。
研究小组还在患者的黑色素瘤样本中观察到相同的LAP1表达模式。与原发肿瘤相比,从黑色素瘤患者转移部位提取的组织样本中LAP1水平更高。在原发肿瘤边缘的细胞中有高水平LAP1的患者具有更强的侵袭性癌症和更差的结果,这表明这种蛋白质可以用来识别可能具有更高侵袭性疾病风险的黑色素瘤患者亚群。
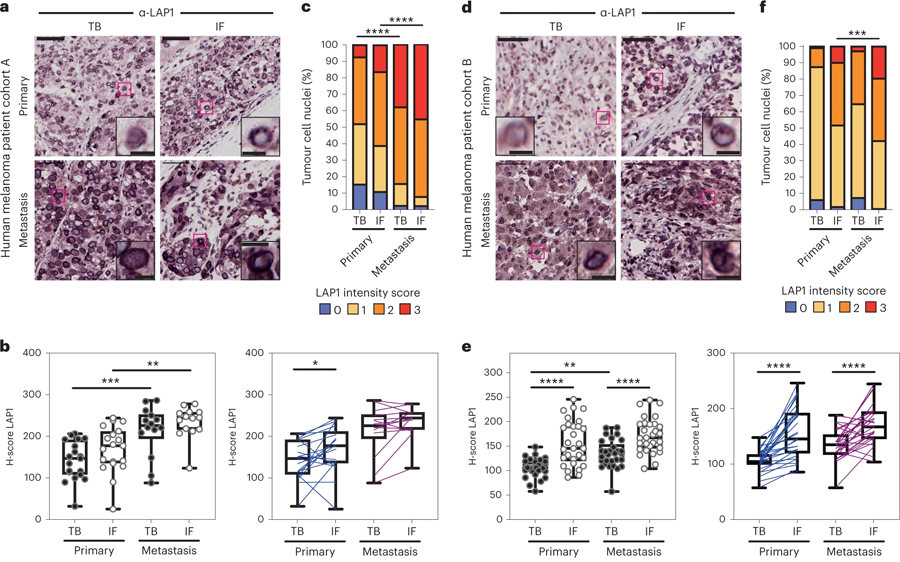
图3 LAP1水平在人类黑色素瘤进展中增加(图源:[1])
Sanz-Moreno教授的研究小组对了解癌细胞如何与环境沟通以促进其生长和扩散感兴趣,他说:
黑素瘤是最具侵略性和最致命的皮肤癌类型。通过结合我的实验室和Carlton博士的专业知识,我们对LAP1如何促进黑色素瘤进展有了新的机制理解,并在实验室和患者模型中证明了LAP1是黑色素瘤侵袭性的关键调节因子。”
“因为LAP1在转移细胞中表达如此之高,干扰这一分子机制可能会对癌症扩散产生重大影响。目前还没有直接靶向LAP1的药物,所以展望未来,我们希望研究靶向LAP1和核膜泡的方法,看看是否有可能阻止黑色素瘤的发展机制。”
研究小组希望研究LAP1驱动的核膜起泡是否发生在其他组成并穿过肿瘤环境的细胞(如免疫细胞)中,确定其他细胞中的这一过程是否有助于或阻碍癌症的进展。
Iain Foulkes博士是英国癌症研究所研究与创新的执行主任,该研究所为这项研究提供了部分资金,他说:
“像这样的研究是一个很好的例子,说明了为什么英国癌症研究中心热衷于资助研究,除了关注临床研究之外,还会进一步了解癌症对我们身体生物学的影响。”
这种对黑素瘤细胞核如何变得更有流动性,能在体内移动的新认识,有助于建立我们对癌症如何运作的认识,并为研究如何使癌症更难扩散开辟了新的途径。”
参考资料:
[1] Jung-Garcia, Y., Maiques, O., Monger, J. et al. LAP1 supports nuclear adaptability during constrained melanoma cell migration and invasion. Nat Cell Biol, 2023 DOI: 10.1038/s41556-022-01042-3
摘要:一项新的研究发现了一种蛋白质,这种蛋白质可以使黑色素瘤(最严重的皮肤癌类型)变得更具侵略性,因为它赋予癌细胞改变细胞核形状的能力——这种特征允许细胞在身体各处迁移和扩散。
伦敦玛丽女王大学、伦敦国王学院和弗朗西斯克里克研究所领导的研究发现了一种蛋白质,这种蛋白质通过赋予癌细胞改变细胞核形状的能力,使黑色素瘤(最严重的皮肤癌类型)更具攻击性,这种特征使细胞能够在全身迁移和扩散。
发表在《自然细胞生物学》杂志上的这项研究,模拟了侵袭性黑色素瘤细胞的行为,这种细胞能够改变细胞核的形状,克服癌细胞在组织中迁移时遇到的物理限制。研究发现,这些侵袭性黑素瘤细胞中含有一种叫做LAP1的蛋白质,这种蛋白质水平的升高与黑素瘤患者预后不良有关。

图1 研究发现LAP1蛋白质的升高与黑素瘤患者预后不良有关(图源:[1])
黑色素瘤是一种皮肤癌,可以扩散到身体的其他器官。癌症扩散或“转移”是癌症相关死亡的主要原因。虽然转移已被广泛研究,但其发生机制尚不清楚。这项研究的发现为黑色素瘤的发展机制提供了新的线索,并可能为开发针对黑色素瘤扩散的新方法铺平道路。
通过细胞核迁移
该研究由巴茨癌症研究所的Victoria Sanz-Moreno教授和伦敦国王学院及弗朗西斯-克里克研究所的Jeremy Carlton博士共同领导,主要由英国癌症研究中心、惠康基金会和巴茨慈善机构资助。
在这项研究中,研究小组在实验中挑战侵袭性和非侵袭性黑素瘤细胞,让它们通过比细胞核尺寸小的人造膜上的孔隙迁移。侵袭性细胞来自一名黑色素瘤患者的转移部位,而侵袭性较低的细胞来自同一名患者的原始或“原发性”黑色素瘤。
为了转移,癌细胞需要从原发肿瘤中分离出来,转移到身体的另一部分并在那里开始生长。然而,肿瘤周围的致密环境使癌细胞很难在物理上进行这种操作。
细胞包含一个大而坚硬的结构,称为细胞核,它存储细胞的遗传信息,但它也限制了细胞通过肿瘤环境中紧密间隙的能力。为了让癌细胞挤过这些缝隙,它们需要让细胞核更具延展性。
迁移实验后进行的成像显示,具有侵袭性的细胞能够比侵袭性较低的细胞更有效地通过孔隙,因为它们在细胞核边缘形成了称为“"blebs(核膜泡,生物通注)”的凸起。对黑色素瘤细胞的遗传分析显示,形成泡状物的侵袭性细胞含有更高水平的LAP1蛋白,这种蛋白位于围绕细胞核的膜(称为核膜)内。

图2 转移性黑色素瘤细胞的NE(核包膜蛋白)是高度活跃的(图源:[1])
Jeremy Carlton博士的实验室对理解细胞内膜结合结构的动力学很感兴趣,他说:
“核膜被拴在下面的细胞核上,我们的研究表明,LAP1蛋白松开了这种束缚,使核膜隆起并形成气泡,使细胞核更流动。因此,癌细胞可以挤过通常会阻止它们的缝隙。”
当研究小组在实验中阻断了侵袭性细胞中LAP1蛋白的产生,然后再让癌细胞通过小孔时,他们发现细胞形成核膜泡的能力较弱,也较难挤过这些空隙。
研究小组还在患者的黑色素瘤样本中观察到相同的LAP1表达模式。与原发肿瘤相比,从黑色素瘤患者转移部位提取的组织样本中LAP1水平更高。在原发肿瘤边缘的细胞中有高水平LAP1的患者具有更强的侵袭性癌症和更差的结果,这表明这种蛋白质可以用来识别可能具有更高侵袭性疾病风险的黑色素瘤患者亚群。

图3 LAP1水平在人类黑色素瘤进展中增加(图源:[1])
Sanz-Moreno教授的研究小组对了解癌细胞如何与环境沟通以促进其生长和扩散感兴趣,他说:
黑素瘤是最具侵略性和最致命的皮肤癌类型。通过结合我的实验室和Carlton博士的专业知识,我们对LAP1如何促进黑色素瘤进展有了新的机制理解,并在实验室和患者模型中证明了LAP1是黑色素瘤侵袭性的关键调节因子。”
“因为LAP1在转移细胞中表达如此之高,干扰这一分子机制可能会对癌症扩散产生重大影响。目前还没有直接靶向LAP1的药物,所以展望未来,我们希望研究靶向LAP1和核膜泡的方法,看看是否有可能阻止黑色素瘤的发展机制。”
研究小组希望研究LAP1驱动的核膜起泡是否发生在其他组成并穿过肿瘤环境的细胞(如免疫细胞)中,确定其他细胞中的这一过程是否有助于或阻碍癌症的进展。
Iain Foulkes博士是英国癌症研究所研究与创新的执行主任,该研究所为这项研究提供了部分资金,他说:
“像这样的研究是一个很好的例子,说明了为什么英国癌症研究中心热衷于资助研究,除了关注临床研究之外,还会进一步了解癌症对我们身体生物学的影响。”
这种对黑素瘤细胞核如何变得更有流动性,能在体内移动的新认识,有助于建立我们对癌症如何运作的认识,并为研究如何使癌症更难扩散开辟了新的途径。”
参考资料:
[1] Jung-Garcia, Y., Maiques, O., Monger, J. et al. LAP1 supports nuclear adaptability during constrained melanoma cell migration and invasion. Nat Cell Biol, 2023 DOI: 10.1038/s41556-022-01042-3



