摘要:哈佛大学的研究人员证实了人类免疫系统并非随机地针对病毒蛋白某个位点产生抗体,免疫显性公共抗体反应——偏向对病毒某些表位产生抗体反应,是由种系编码的氨基酸结合(GRAB)基序驱动的,这对病毒施加的选择性压力会影响宿主-病原体共同进化,也可对疫苗设计产生影响。
尽管抗体库有着巨大的多样性,但已有尚未明确证实的迹象表明,人类的免疫系统并非随机地针对病毒蛋白质的任意位点。不同的个体在暴露于某种病原体后会产生针对抗原中完全相同的表位的抗体。免疫显性公共抗体反应是一种广泛共享的对病原体的免疫反应,在不同的人身上,病毒蛋白质上相同的表位最终会被相同的抗体(公共抗体)靶向,这种现象背后的免疫机制尚不清楚。这一对“某些抗原表位的偏向”现象似乎反映了我们免疫系统的高效倾向,但有时却会让我们变得脆弱。也就是说,它可能会导致我们总是重复产生针对相同靶点的抗体,即使这些抗体没有保护作用。或者,它可以给SARS-CoV-2等病毒提供一种逃避免疫反应的简单方法。例如,一种病毒可以使少数目标残基发生突变,从而获得战胜许多人普遍拥有的抗体的能力。
基本背景
抗体是由发生在免疫球蛋白重链和轻链基因中的DNA重组机制产生的,其中模块化的VDJ(重链)和VJ(轻链)基因片段组合组装而成。抗体库的巨大复杂性使得许多物种可以产生针对几乎任何蛋白质的抗体。然而,当不同的个体暴露于特定的病原体时,他们通常会对病原体的相同精确的蛋白质区域(或表位)产生抗体反应。这些反复出现的抗体对免疫显性“公共表位”的反应机制尚不清楚。在这项研究之前,有迹象表明,人类的免疫系统并不是随机地针对病毒蛋白质的位点。在一些孤立的例子中,研究人员发现不同个体之间会出现同样的——锁定相同的病毒蛋白质位点(称为表位)——的抗体反应。
研究简介
根据哈佛大学的研究人员领导的一项新研究表明,由于种系编码的氨基酸结合(GRAB)基序,抗体的产生远非随机的。GRAB基序代表了抗体库结构的种系编码成分,使抗体易于识别特定结构,从而影响表位的选择和组成。这项名为“种系编码的氨基酸结合基序驱动免疫显性公共抗体反应”的研究报告发表在《Science》杂志上。

图1 研究表明由于种系编码的氨基酸结合(GRAB)基序,抗体的产生远非随机的
该团队使用了Brigham和哈佛医学院教授Stephen J. Elledge实验室在2015年开发的一种名为VirScan的噬菌体展示平台——用于展示筛选覆盖整个人类病毒的肽库,以高通量方式从一大群个体中识别抗病毒抗体的表位。该工具可以检测数千个病毒表位(抗体识别和结合的病毒上的位点),并从一滴血中提供一个人的免疫历史的快照。在这项新研究中,研究人员使用VirScan分析了来自美国、秘鲁和法国参与者的569份血液样本。他们发现,识别公共表位是人类抗体反应的一个普遍特征,许多人类V基因片段含有种系编码的氨基酸结合(GRAB)基序,这些基序结合特定的氨基酸,对抗体识别至关重要。此外,对小鼠和人类GRAB基序的比较发现只有部分重叠,这可能解释了不同物种偏向针对不同的公共表位。
通过以高分辨率绘制来自51种病毒的376个免疫显性“公共表位”,并表征它们的几种同源抗体,研究人员得出结论:抗体中的种系编码序列驱动了重复性识别。对抗体-抗原结构的系统分析发现,在重V基因段和轻V基因段中,有18个人类和21个部分重叠的小鼠种系编码氨基酸结合(GRAB)基序(motif),在案例研究中,这些基序被证明对公共表位识别至关重要。GRAB基序代表了免疫系统结构的一个基本组成部分,它促进了病原体的识别,并导致了物种特异性的公共抗体反应,可以对病原体施加选择性压力。GRAB基序对应于特别擅长挑选特定氨基酸的抗体区域。它们有助于解释为什么人类抗体倾向于集中在这些氨基酸可以结合的区域,从而反复结合相同的点。少量的突变可以帮助病毒避免被这些共享抗体检测到,使病毒重新感染先前免疫的人群。
研究结果
他们绘制了来自51种病毒的376个免疫显性公共表位的单氨基酸分辨率。来自不同个体的识别同一公共表位的抗体通常(i)共享轻链同型(kappa或lambda)和(ii)结合表位中相同的精确关键残基。公共表位显示出偏倚的氨基酸组成,包括在公共表位的边界赖氨酸显著富集,由lambda轻链抗体识别。他们详细检查了50个B细胞受体识别三种模式公共表位,并观察到保守的V基因片段使用,但几乎没有重链CDR3序列的保守,这表明关键特异性决定因素位于V基因片段本身。PDB中抗体-抗原复合物的结构分析揭示了18个人V基因片段,这些片段含有种系编码的氨基酸结合(GRAB)基序,这些基序专门与特定的氨基酸结合。其中包括6个密切相关的lambda V基因片段,具有类似的针对边界赖氨酸的GRAB基序。他们证实,鉴定的GRAB基序对于两种模型公共表位的抗体识别至关重要。对小鼠抗体-抗原结构的分析显示,21 V基因片段编码的GRAB基序仅与人类GRAB基序部分重叠,这可能解释了为什么跨物种识别的公共表位之间几乎没有重叠。因此,人类对免疫显性公共表位的体液免疫反应的显著趋同和不同物种对公共表位的不同选择似乎有一个结构基础。
研究结论
抗体对免疫显性公共表位的反复反应是体液免疫的一般特征,是由GRAB基序驱动的,GRAB基序是抗体库结构的一种种系编码成分,易于使抗体识别特定结构,从而影响表位的选择和组成。公共表位的出现可能部分是因为它们最容易被GRAB基序识别,因此可以与相对较大的B细胞前体库结合。GRAB基序的进化可能是为了确保有效的抗体对病原体的反应;它们在种群中产生的反复反应可能对病原体施加选择压力,并影响宿主-病原体的共同进化。
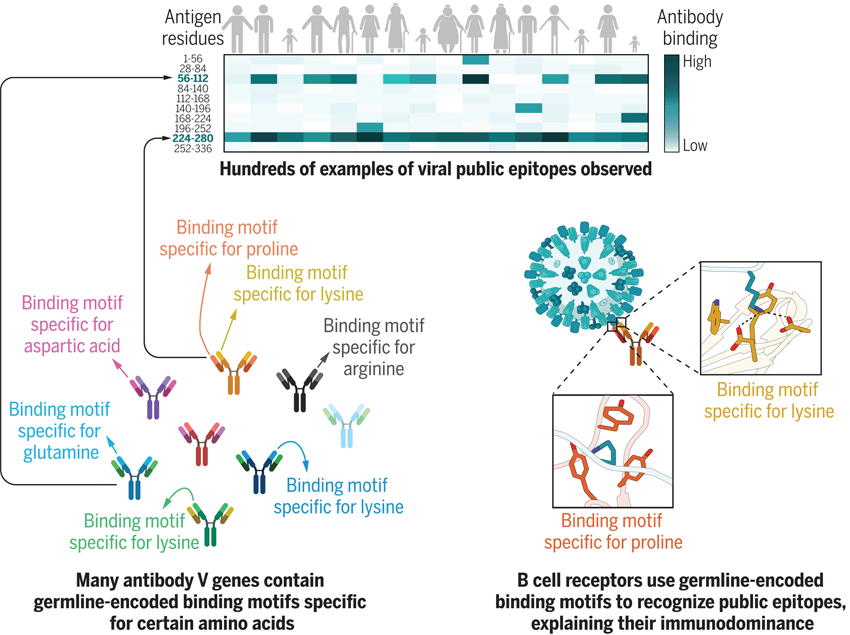
图2 抗体对免疫显性公共表位的反复反应是由GRAB基序驱动
作者看法
“我们在免疫系统中发现了一种潜在的结构,它会导致人们,无论他们生活在世界上哪个地方,产生基本上相同的抗体,让病毒能够避开极少数的目标,从而重新感染人们,并继续扩大和进一步进化。”有趣的是,研究小组注意到,非人类物种产生的抗体可以识别与人类识别的不同的公共表位。而且,虽然一个人更有可能产生针对公共表位的抗体,但有些人确实会产生更罕见的抗体,这可能更有效地保护他们免受再次感染。这些见解可能对开发针对COVID-19的治疗方法(如单克隆抗体)以及疫苗设计产生重要影响。“越独特的抗体可能让病毒越难以逃避。”“在我们考虑设计更好的疗法和疫苗时,(这一点)很重要。”“我们的研究可能有助于解释我们在COVID-19大流行期间看到的许多模式,特别是在再次感染方面,”通讯作者、Brigham和哈佛医学院教授Stephen J. Elledge博士表示:“我们的发现可以帮助了解免疫预测,并可能改变人们对免疫策略的看法。”
参考资料:
[1]Germline-encoded amino acid–binding motifs drive immunodominant public antibody responses
摘要:哈佛大学的研究人员证实了人类免疫系统并非随机地针对病毒蛋白某个位点产生抗体,免疫显性公共抗体反应——偏向对病毒某些表位产生抗体反应,是由种系编码的氨基酸结合(GRAB)基序驱动的,这对病毒施加的选择性压力会影响宿主-病原体共同进化,也可对疫苗设计产生影响。
尽管抗体库有着巨大的多样性,但已有尚未明确证实的迹象表明,人类的免疫系统并非随机地针对病毒蛋白质的任意位点。不同的个体在暴露于某种病原体后会产生针对抗原中完全相同的表位的抗体。免疫显性公共抗体反应是一种广泛共享的对病原体的免疫反应,在不同的人身上,病毒蛋白质上相同的表位最终会被相同的抗体(公共抗体)靶向,这种现象背后的免疫机制尚不清楚。这一对“某些抗原表位的偏向”现象似乎反映了我们免疫系统的高效倾向,但有时却会让我们变得脆弱。也就是说,它可能会导致我们总是重复产生针对相同靶点的抗体,即使这些抗体没有保护作用。或者,它可以给SARS-CoV-2等病毒提供一种逃避免疫反应的简单方法。例如,一种病毒可以使少数目标残基发生突变,从而获得战胜许多人普遍拥有的抗体的能力。
基本背景
抗体是由发生在免疫球蛋白重链和轻链基因中的DNA重组机制产生的,其中模块化的VDJ(重链)和VJ(轻链)基因片段组合组装而成。抗体库的巨大复杂性使得许多物种可以产生针对几乎任何蛋白质的抗体。然而,当不同的个体暴露于特定的病原体时,他们通常会对病原体的相同精确的蛋白质区域(或表位)产生抗体反应。这些反复出现的抗体对免疫显性“公共表位”的反应机制尚不清楚。在这项研究之前,有迹象表明,人类的免疫系统并不是随机地针对病毒蛋白质的位点。在一些孤立的例子中,研究人员发现不同个体之间会出现同样的——锁定相同的病毒蛋白质位点(称为表位)——的抗体反应。
研究简介
根据哈佛大学的研究人员领导的一项新研究表明,由于种系编码的氨基酸结合(GRAB)基序,抗体的产生远非随机的。GRAB基序代表了抗体库结构的种系编码成分,使抗体易于识别特定结构,从而影响表位的选择和组成。这项名为“种系编码的氨基酸结合基序驱动免疫显性公共抗体反应”的研究报告发表在《Science》杂志上。

图1 研究表明由于种系编码的氨基酸结合(GRAB)基序,抗体的产生远非随机的
该团队使用了Brigham和哈佛医学院教授Stephen J. Elledge实验室在2015年开发的一种名为VirScan的噬菌体展示平台——用于展示筛选覆盖整个人类病毒的肽库,以高通量方式从一大群个体中识别抗病毒抗体的表位。该工具可以检测数千个病毒表位(抗体识别和结合的病毒上的位点),并从一滴血中提供一个人的免疫历史的快照。在这项新研究中,研究人员使用VirScan分析了来自美国、秘鲁和法国参与者的569份血液样本。他们发现,识别公共表位是人类抗体反应的一个普遍特征,许多人类V基因片段含有种系编码的氨基酸结合(GRAB)基序,这些基序结合特定的氨基酸,对抗体识别至关重要。此外,对小鼠和人类GRAB基序的比较发现只有部分重叠,这可能解释了不同物种偏向针对不同的公共表位。
通过以高分辨率绘制来自51种病毒的376个免疫显性“公共表位”,并表征它们的几种同源抗体,研究人员得出结论:抗体中的种系编码序列驱动了重复性识别。对抗体-抗原结构的系统分析发现,在重V基因段和轻V基因段中,有18个人类和21个部分重叠的小鼠种系编码氨基酸结合(GRAB)基序(motif),在案例研究中,这些基序被证明对公共表位识别至关重要。GRAB基序代表了免疫系统结构的一个基本组成部分,它促进了病原体的识别,并导致了物种特异性的公共抗体反应,可以对病原体施加选择性压力。GRAB基序对应于特别擅长挑选特定氨基酸的抗体区域。它们有助于解释为什么人类抗体倾向于集中在这些氨基酸可以结合的区域,从而反复结合相同的点。少量的突变可以帮助病毒避免被这些共享抗体检测到,使病毒重新感染先前免疫的人群。
研究结果
他们绘制了来自51种病毒的376个免疫显性公共表位的单氨基酸分辨率。来自不同个体的识别同一公共表位的抗体通常(i)共享轻链同型(kappa或lambda)和(ii)结合表位中相同的精确关键残基。公共表位显示出偏倚的氨基酸组成,包括在公共表位的边界赖氨酸显著富集,由lambda轻链抗体识别。他们详细检查了50个B细胞受体识别三种模式公共表位,并观察到保守的V基因片段使用,但几乎没有重链CDR3序列的保守,这表明关键特异性决定因素位于V基因片段本身。PDB中抗体-抗原复合物的结构分析揭示了18个人V基因片段,这些片段含有种系编码的氨基酸结合(GRAB)基序,这些基序专门与特定的氨基酸结合。其中包括6个密切相关的lambda V基因片段,具有类似的针对边界赖氨酸的GRAB基序。他们证实,鉴定的GRAB基序对于两种模型公共表位的抗体识别至关重要。对小鼠抗体-抗原结构的分析显示,21 V基因片段编码的GRAB基序仅与人类GRAB基序部分重叠,这可能解释了为什么跨物种识别的公共表位之间几乎没有重叠。因此,人类对免疫显性公共表位的体液免疫反应的显著趋同和不同物种对公共表位的不同选择似乎有一个结构基础。
研究结论
抗体对免疫显性公共表位的反复反应是体液免疫的一般特征,是由GRAB基序驱动的,GRAB基序是抗体库结构的一种种系编码成分,易于使抗体识别特定结构,从而影响表位的选择和组成。公共表位的出现可能部分是因为它们最容易被GRAB基序识别,因此可以与相对较大的B细胞前体库结合。GRAB基序的进化可能是为了确保有效的抗体对病原体的反应;它们在种群中产生的反复反应可能对病原体施加选择压力,并影响宿主-病原体的共同进化。

图2 抗体对免疫显性公共表位的反复反应是由GRAB基序驱动
作者看法
“我们在免疫系统中发现了一种潜在的结构,它会导致人们,无论他们生活在世界上哪个地方,产生基本上相同的抗体,让病毒能够避开极少数的目标,从而重新感染人们,并继续扩大和进一步进化。”有趣的是,研究小组注意到,非人类物种产生的抗体可以识别与人类识别的不同的公共表位。而且,虽然一个人更有可能产生针对公共表位的抗体,但有些人确实会产生更罕见的抗体,这可能更有效地保护他们免受再次感染。这些见解可能对开发针对COVID-19的治疗方法(如单克隆抗体)以及疫苗设计产生重要影响。“越独特的抗体可能让病毒越难以逃避。”“在我们考虑设计更好的疗法和疫苗时,(这一点)很重要。”“我们的研究可能有助于解释我们在COVID-19大流行期间看到的许多模式,特别是在再次感染方面,”通讯作者、Brigham和哈佛医学院教授Stephen J. Elledge博士表示:“我们的发现可以帮助了解免疫预测,并可能改变人们对免疫策略的看法。”
参考资料:
[1]Germline-encoded amino acid–binding motifs drive immunodominant public antibody responses



