摘要:肺癌脑转移导致高死亡率,但转移的确切机制尚不清楚。
2023年8月17日,广州医科大学何建行及克利夫兰诊所鲍仕登共同通讯在Cancer Cell 在线发表题为“CD44+ lung cancer stem cell-derived pericyte-like cells cause brain metastases through GPR124-enhanced trans-endothelial migration”的研究论文,该研究表明报道了肺腺癌(ADC)中来自CD44+肺癌干细胞(CSCs)的血管周细胞通过G蛋白偶联受体124 (GPR124)增强的跨内皮迁移(TEM)引起肿瘤脑转移。
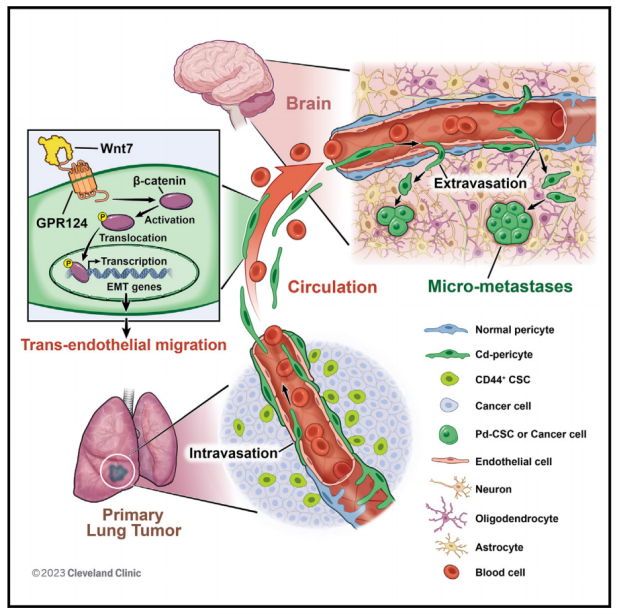
在肺ADC中,血管周围壁龛中的CD44+ CSCs生成了大部分血管周细胞。CSCs衍生的周细胞样细胞(CD-周细胞)表现出显著的TEM能力,可以有效地内渗到血管腔内,在循环中存活,外渗到脑实质,然后去分化为致瘤性CSCs形成转移灶。CD-周细胞独特表达GPR124,激活Wnt7-β-catenin信号,增强CD-周细胞的TEM内渗和外渗能力,这是肿瘤转移的两个关键步骤。此外,CD-周细胞、GPR124或Wnt7-β-catenin信号的选择性破坏可显著减少肺ADC的脑和肝转移。该研究揭示了一种未被认识的驱动肿瘤转移的细胞和分子模式。

图1 肺腺癌(ADC)中来自CD44+肺癌干细胞(CSCs)的血管周细胞通过G蛋白偶联受体124 (GPR124)增强的跨内皮迁移(TEM)引起肿瘤脑转移
肿瘤转移是癌症相关死亡的主要原因。超过90%的癌症死亡可归因于转移。转移是一个复杂的过程,有多个连续的步骤。内渗和外渗是癌细胞跨内皮迁移(trans-endothelial migration, TEM)跨越血管的关键过程。肿瘤转移效率极低。只有那些有能力成功完成所有基本步骤的癌细胞才能最终导致可检测的转移。在转移性癌症中,肺癌在世界范围内的死亡率很高。肺癌占所有脑转移瘤的40-50%。
恶性肺癌在组织学上分为非小细胞肺癌(NSCLC,约占85%)和小细胞肺癌(SCLCs,约占15%)。非小细胞肺癌主要包括肺腺癌(ADC)、鳞状细胞癌(SCC)和大细胞癌。大约50%的肺癌患者在疾病进展过程中发生脑转移。尽管近年来在治疗原发性肺癌方面取得了进展,但脑转移患者的生存率仍然非常低。脑转移治疗的显著失败归因于多种因素,包括肿瘤异质性、治疗耐药性和阻断抗癌药物有效递送的血脑屏障(BBB),但对频繁脑转移机制的了解不足是一个明显的障碍。
与大多数恶性肿瘤相似,肺ADC具有高度异质性,并含有癌症干细胞(CSCs)。CSCs通常存在于血管周围壁龛中,并与肿瘤微环境中的其他细胞和成分相互作用。尽管CD44、ALDH(醛脱氢酶)、CD133 (PROM1)和CD117 (KIT)等几种上调标记物与肺ADC中的CSC特性相关,但CD44被广泛用于识别肺ADC中的CSC。有报道称,肺ADC中CD44表达与上皮-间质转化(EMT)呈正相关。CSCs是促进恶性生长、治疗抵抗和肿瘤复发的关键癌细胞。CSCs被提出可能通过EMT重编程促进肿瘤转移,但CD44 CSCs究竟如何参与肿瘤转移仍然难以捉摸。
机理模式图(图源自Cancer Cell )
该研究发现CD44+ CSC衍生的周细胞样细胞(CD-周细胞)通过G蛋白偶联受体124 (GPR124)介导的Wnt7-β-catenin信号传导,显示出强大的TEM内渗和外渗能力,从而导致脑转移。总之,该研究揭示了一个未知的细胞模式和分子机制驱动肿瘤转移,特别是肺ADC的脑转移。由于乳腺癌等其他恶性肿瘤也会转移到大脑,因此确定这里确定的机制是否适用于其他转移性肿瘤将是非常有趣的。该研究为更好地了解肿瘤转移打开了一扇独特的窗口,也为预防或减少转移提供了一种治疗策略。
[1] CD44+ lung cancer stem cell-derived pericyte-like cells cause brain metastases through GPR124-enhanced trans-endothelial migration
摘要:肺癌脑转移导致高死亡率,但转移的确切机制尚不清楚。
2023年8月17日,广州医科大学何建行及克利夫兰诊所鲍仕登共同通讯在Cancer Cell 在线发表题为“CD44+ lung cancer stem cell-derived pericyte-like cells cause brain metastases through GPR124-enhanced trans-endothelial migration”的研究论文,该研究表明报道了肺腺癌(ADC)中来自CD44+肺癌干细胞(CSCs)的血管周细胞通过G蛋白偶联受体124 (GPR124)增强的跨内皮迁移(TEM)引起肿瘤脑转移。
在肺ADC中,血管周围壁龛中的CD44+ CSCs生成了大部分血管周细胞。CSCs衍生的周细胞样细胞(CD-周细胞)表现出显著的TEM能力,可以有效地内渗到血管腔内,在循环中存活,外渗到脑实质,然后去分化为致瘤性CSCs形成转移灶。CD-周细胞独特表达GPR124,激活Wnt7-β-catenin信号,增强CD-周细胞的TEM内渗和外渗能力,这是肿瘤转移的两个关键步骤。此外,CD-周细胞、GPR124或Wnt7-β-catenin信号的选择性破坏可显著减少肺ADC的脑和肝转移。该研究揭示了一种未被认识的驱动肿瘤转移的细胞和分子模式。

图1 肺腺癌(ADC)中来自CD44+肺癌干细胞(CSCs)的血管周细胞通过G蛋白偶联受体124 (GPR124)增强的跨内皮迁移(TEM)引起肿瘤脑转移
肿瘤转移是癌症相关死亡的主要原因。超过90%的癌症死亡可归因于转移。转移是一个复杂的过程,有多个连续的步骤。内渗和外渗是癌细胞跨内皮迁移(trans-endothelial migration, TEM)跨越血管的关键过程。肿瘤转移效率极低。只有那些有能力成功完成所有基本步骤的癌细胞才能最终导致可检测的转移。在转移性癌症中,肺癌在世界范围内的死亡率很高。肺癌占所有脑转移瘤的40-50%。
恶性肺癌在组织学上分为非小细胞肺癌(NSCLC,约占85%)和小细胞肺癌(SCLCs,约占15%)。非小细胞肺癌主要包括肺腺癌(ADC)、鳞状细胞癌(SCC)和大细胞癌。大约50%的肺癌患者在疾病进展过程中发生脑转移。尽管近年来在治疗原发性肺癌方面取得了进展,但脑转移患者的生存率仍然非常低。脑转移治疗的显著失败归因于多种因素,包括肿瘤异质性、治疗耐药性和阻断抗癌药物有效递送的血脑屏障(BBB),但对频繁脑转移机制的了解不足是一个明显的障碍。
与大多数恶性肿瘤相似,肺ADC具有高度异质性,并含有癌症干细胞(CSCs)。CSCs通常存在于血管周围壁龛中,并与肿瘤微环境中的其他细胞和成分相互作用。尽管CD44、ALDH(醛脱氢酶)、CD133 (PROM1)和CD117 (KIT)等几种上调标记物与肺ADC中的CSC特性相关,但CD44被广泛用于识别肺ADC中的CSC。有报道称,肺ADC中CD44表达与上皮-间质转化(EMT)呈正相关。CSCs是促进恶性生长、治疗抵抗和肿瘤复发的关键癌细胞。CSCs被提出可能通过EMT重编程促进肿瘤转移,但CD44 CSCs究竟如何参与肿瘤转移仍然难以捉摸。

机理模式图(图源自Cancer Cell )
该研究发现CD44+ CSC衍生的周细胞样细胞(CD-周细胞)通过G蛋白偶联受体124 (GPR124)介导的Wnt7-β-catenin信号传导,显示出强大的TEM内渗和外渗能力,从而导致脑转移。总之,该研究揭示了一个未知的细胞模式和分子机制驱动肿瘤转移,特别是肺ADC的脑转移。由于乳腺癌等其他恶性肿瘤也会转移到大脑,因此确定这里确定的机制是否适用于其他转移性肿瘤将是非常有趣的。该研究为更好地了解肿瘤转移打开了一扇独特的窗口,也为预防或减少转移提供了一种治疗策略。
[1] CD44+ lung cancer stem cell-derived pericyte-like cells cause brain metastases through GPR124-enhanced trans-endothelial migration



