摘要:研究人员使用基于CRISPR的筛选平台发现,转录因子基因BATF3代表一个单一的主基因组调节因子,可用于重新编程T细胞中数千个基因的网络,并大大增强癌细胞的杀伤能力。
杜克大学(Duke University)的研究人员利用CRISPR技术对人类免疫细胞中的基因功能进行了高通量筛选,并发现基因组的单个主调节器可用于重新编程T细胞中数千个基因的网络,并大大增强癌细胞的杀伤能力。
这种主调节转录因子(TF)基因被称为BATF3,是研究人员发现并测试用于改善T细胞疗法的几个基因之一。这些靶点,以及用来识别、测试和操纵它们的方法,可以使目前正在使用和正在开发的任何t细胞癌症疗法更加有效。结合其他进展,该平台还可以实现通用的、现成的治疗版本,并扩展到其他疾病领域,如自身免疫性疾病。
“使用T细胞对抗癌症的一个已知障碍是,随着时间的推移,它们往往会‘疲劳’,失去杀死癌细胞的能力,”该团队发表在《Nature Genetics》上的论文的共同主要作者Sean McCutcheon说。“我们正在通过模仿在临床产品中效果良好的自然发生的细胞状态,确定使T细胞更强大、更有弹性的操作方法。”
McCutcheon和研究负责人Charles Gersbach博士,杜克大学John W. Strohbehn杰出生物医学工程教授,以及同事们在一篇题为“Transcriptional and epigenetic regulators of human CD8+ T cell function identified through orthogonal CRISPR screens”的论文中报告了他们的发现。

图1 通过CRISPR正交筛选鉴定人CD8+T细胞功能的转录和表观遗传学调控因子
T细胞疗法是一种已有十年历史的治疗癌症的方法。最近的一些方法包括对免疫系统细胞进行重新编程,以寻找并摧毁它们可能忽略的癌细胞。许多公司都在努力改进这项技术,主要是通过使用基因工程技术来指导T细胞如何识别癌细胞,并使它们更有效地消灭癌细胞。
作者指出:“过继T细胞疗法(ACT)具有巨大的癌症治疗潜力,通过表达识别并结合肿瘤相关抗原的工程受体,将T细胞重定向到癌细胞。”
目前有6种FDA批准的T细胞疗法用于治疗特定的白血病、淋巴瘤和多发性骨髓瘤。然而,尽管在某些研究中有成功的迹象,但这些方法和治疗方法目前在应用于实体瘤时效果并不好。实体肿瘤通常会给T细胞带来巨大的物理障碍,需要克服这些障碍,而呈现靶标的癌细胞的绝对数量和密度会导致T细胞衰竭,从而使T细胞不再能够产生抗肿瘤反应。
Gersbach说:“在某些情况下,T细胞疗法就像一种神奇的药物,但在大多数情况下,它几乎不起作用。我们正在寻找通用的解决方案,通过重新编程它们的基因调控软件,而不是重写或破坏它们的基因硬件,使这些细胞变得更好。”
Gersbach和他的实验室在过去几年里一直在开发一种方法,该方法使用基因编辑技术CRISPR-Cas9的一个版本,在不切割基因的情况下探索和调节基因。相反,它改变了包装和储存DNA的结构,影响了伴随基因的活性水平。
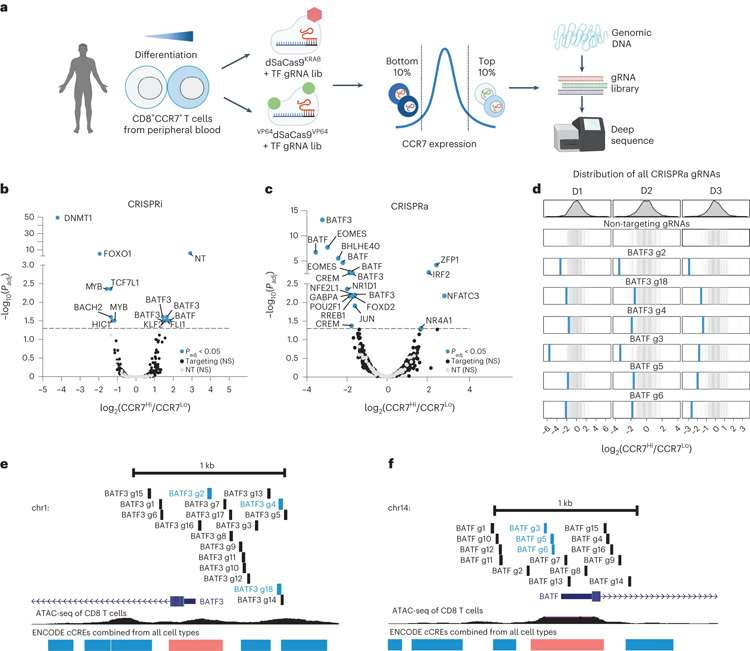
图2 T细胞耗竭的特征是代谢重编程
在Gersbach实验室工作的博士候选人McCutcheon,专注于研究“黑暗基因组”的区域,当T细胞在不同状态之间转换时,如功能和耗尽,这些区域会发生变化。研究人员评论说:“在这里,我们开发了汇总的表观遗传CRISPR筛选方法,以系统地描述激活或抑制120个转录和表观遗传调节因子对人类CD8+ T细胞状态的影响。”通过他们的筛选,研究人员确定了120个编码“主调节器”的基因,这些基因负责许多其他基因的活性水平。利用CRISPR平台,研究人员上下调节了这些靶标的活性水平,以了解它们如何影响T细胞功能的其他已知标记。
虽然出现了几个有希望的候选基因,其中最有希望的是一个名为BATF3的基因。当McCutcheon随后将BATF3直接传递给T细胞时,T细胞DNA的包装结构发生了数千次调整,这与增强的效力和抗衰竭能力有关。“我们发现BATF3过表达促进了记忆T细胞的特定特征,并减弱了与细胞毒性、调节性T细胞功能和衰竭相关的基因程序。”在慢性抗原刺激下,BATF3过表达对抗T细胞耗竭的表型和表观遗传特征。
研究人员对BATF3进行了一系列测试。在一个小鼠模型中,当他们在T细胞中过度表达BATF3来攻击人类乳腺癌肿瘤时,最有趣的结果出现了。虽然标准的T细胞疗法难以减缓肿瘤的生长,但同样剂量的经BATF3改造的T细胞完全根除了肿瘤。“BATF3增强了CAR - T细胞在体外和体内肿瘤模型中的效力,并编程了与过继性T细胞治疗的积极临床反应相关的转录谱。”
虽然BATF3的结果很有希望,但该团队对识别和调节主调节因子以提高治疗效果的方法的总体成功更加热情,他们已经开发了十年的大部分时间。
研究人员现在可以使用任何T细胞来源或癌症模型,在模拟临床环境的各种实验条件下,很容易地分析T细胞适应性的主要调节因子。Gersbach指出:“这一证明是克服一个主要障碍的关键一步,使T细胞疗法在更多癌症类型的患者中发挥作用。”
在报告的研究的最后一部分,McCutcheon筛选了T细胞,无论是否有BATF3,同时使用CRISPR去除基因表达的所有其他主要调节因子-总共超过1600个调节因子。“我们进行了CRISPR敲除筛选,确定了BATF3基因网络的辅助因子和下游介质,这导致了一组全新的因子的发现,这些因子可以单独靶向或与BATF3结合,以提高T细胞治疗的效力。总的来说,这项工作扩展了表观基因组编辑器的工具包,以及我们对CD8+ T细胞状态和功能调节因子的理解。这个基因目录可以作为设计下一代癌症免疫疗法的基础。”
Gersbach说:“这项研究的重点是通过这些CRISPR筛选确定的一个特定目标,但现在肖恩和他的团队已经启动并运行了整个发现引擎,我们可以一次又一次地对不同的模型和肿瘤类型进行研究。这项研究提出了许多应用这种方法来增强T细胞治疗的策略,从使用患者自己的T细胞到拥有用于各种癌症的广义T细胞库。我们希望这些技术能够普遍适用于所有战略。”
参考资料
[1] Transcriptional and epigenetic regulators of human CD8+ T cell function identified through orthogonal CRISPR screens
摘要:研究人员使用基于CRISPR的筛选平台发现,转录因子基因BATF3代表一个单一的主基因组调节因子,可用于重新编程T细胞中数千个基因的网络,并大大增强癌细胞的杀伤能力。
杜克大学(Duke University)的研究人员利用CRISPR技术对人类免疫细胞中的基因功能进行了高通量筛选,并发现基因组的单个主调节器可用于重新编程T细胞中数千个基因的网络,并大大增强癌细胞的杀伤能力。
这种主调节转录因子(TF)基因被称为BATF3,是研究人员发现并测试用于改善T细胞疗法的几个基因之一。这些靶点,以及用来识别、测试和操纵它们的方法,可以使目前正在使用和正在开发的任何t细胞癌症疗法更加有效。结合其他进展,该平台还可以实现通用的、现成的治疗版本,并扩展到其他疾病领域,如自身免疫性疾病。
“使用T细胞对抗癌症的一个已知障碍是,随着时间的推移,它们往往会‘疲劳’,失去杀死癌细胞的能力,”该团队发表在《Nature Genetics》上的论文的共同主要作者Sean McCutcheon说。“我们正在通过模仿在临床产品中效果良好的自然发生的细胞状态,确定使T细胞更强大、更有弹性的操作方法。”
McCutcheon和研究负责人Charles Gersbach博士,杜克大学John W. Strohbehn杰出生物医学工程教授,以及同事们在一篇题为“Transcriptional and epigenetic regulators of human CD8+ T cell function identified through orthogonal CRISPR screens”的论文中报告了他们的发现。

图1 通过CRISPR正交筛选鉴定人CD8+T细胞功能的转录和表观遗传学调控因子
T细胞疗法是一种已有十年历史的治疗癌症的方法。最近的一些方法包括对免疫系统细胞进行重新编程,以寻找并摧毁它们可能忽略的癌细胞。许多公司都在努力改进这项技术,主要是通过使用基因工程技术来指导T细胞如何识别癌细胞,并使它们更有效地消灭癌细胞。
作者指出:“过继T细胞疗法(ACT)具有巨大的癌症治疗潜力,通过表达识别并结合肿瘤相关抗原的工程受体,将T细胞重定向到癌细胞。”
目前有6种FDA批准的T细胞疗法用于治疗特定的白血病、淋巴瘤和多发性骨髓瘤。然而,尽管在某些研究中有成功的迹象,但这些方法和治疗方法目前在应用于实体瘤时效果并不好。实体肿瘤通常会给T细胞带来巨大的物理障碍,需要克服这些障碍,而呈现靶标的癌细胞的绝对数量和密度会导致T细胞衰竭,从而使T细胞不再能够产生抗肿瘤反应。
Gersbach说:“在某些情况下,T细胞疗法就像一种神奇的药物,但在大多数情况下,它几乎不起作用。我们正在寻找通用的解决方案,通过重新编程它们的基因调控软件,而不是重写或破坏它们的基因硬件,使这些细胞变得更好。”
Gersbach和他的实验室在过去几年里一直在开发一种方法,该方法使用基因编辑技术CRISPR-Cas9的一个版本,在不切割基因的情况下探索和调节基因。相反,它改变了包装和储存DNA的结构,影响了伴随基因的活性水平。

图2 T细胞耗竭的特征是代谢重编程
在Gersbach实验室工作的博士候选人McCutcheon,专注于研究“黑暗基因组”的区域,当T细胞在不同状态之间转换时,如功能和耗尽,这些区域会发生变化。研究人员评论说:“在这里,我们开发了汇总的表观遗传CRISPR筛选方法,以系统地描述激活或抑制120个转录和表观遗传调节因子对人类CD8+ T细胞状态的影响。”通过他们的筛选,研究人员确定了120个编码“主调节器”的基因,这些基因负责许多其他基因的活性水平。利用CRISPR平台,研究人员上下调节了这些靶标的活性水平,以了解它们如何影响T细胞功能的其他已知标记。
虽然出现了几个有希望的候选基因,其中最有希望的是一个名为BATF3的基因。当McCutcheon随后将BATF3直接传递给T细胞时,T细胞DNA的包装结构发生了数千次调整,这与增强的效力和抗衰竭能力有关。“我们发现BATF3过表达促进了记忆T细胞的特定特征,并减弱了与细胞毒性、调节性T细胞功能和衰竭相关的基因程序。”在慢性抗原刺激下,BATF3过表达对抗T细胞耗竭的表型和表观遗传特征。
研究人员对BATF3进行了一系列测试。在一个小鼠模型中,当他们在T细胞中过度表达BATF3来攻击人类乳腺癌肿瘤时,最有趣的结果出现了。虽然标准的T细胞疗法难以减缓肿瘤的生长,但同样剂量的经BATF3改造的T细胞完全根除了肿瘤。“BATF3增强了CAR - T细胞在体外和体内肿瘤模型中的效力,并编程了与过继性T细胞治疗的积极临床反应相关的转录谱。”
虽然BATF3的结果很有希望,但该团队对识别和调节主调节因子以提高治疗效果的方法的总体成功更加热情,他们已经开发了十年的大部分时间。
研究人员现在可以使用任何T细胞来源或癌症模型,在模拟临床环境的各种实验条件下,很容易地分析T细胞适应性的主要调节因子。Gersbach指出:“这一证明是克服一个主要障碍的关键一步,使T细胞疗法在更多癌症类型的患者中发挥作用。”
在报告的研究的最后一部分,McCutcheon筛选了T细胞,无论是否有BATF3,同时使用CRISPR去除基因表达的所有其他主要调节因子-总共超过1600个调节因子。“我们进行了CRISPR敲除筛选,确定了BATF3基因网络的辅助因子和下游介质,这导致了一组全新的因子的发现,这些因子可以单独靶向或与BATF3结合,以提高T细胞治疗的效力。总的来说,这项工作扩展了表观基因组编辑器的工具包,以及我们对CD8+ T细胞状态和功能调节因子的理解。这个基因目录可以作为设计下一代癌症免疫疗法的基础。”
Gersbach说:“这项研究的重点是通过这些CRISPR筛选确定的一个特定目标,但现在肖恩和他的团队已经启动并运行了整个发现引擎,我们可以一次又一次地对不同的模型和肿瘤类型进行研究。这项研究提出了许多应用这种方法来增强T细胞治疗的策略,从使用患者自己的T细胞到拥有用于各种癌症的广义T细胞库。我们希望这些技术能够普遍适用于所有战略。”
参考资料
[1] Transcriptional and epigenetic regulators of human CD8+ T cell function identified through orthogonal CRISPR screens



