摘要:圣路易斯华盛顿大学医学院的研究人员发现,一种被称为胆固醇酯的胆固醇在患有类似阿尔茨海默病的老鼠的大脑中积累,清除胆固醇酯有助于防止脑损伤和行为改变。
在阿尔茨海默病和相关的痴呆症中,认知能力下降是由一种被称为tau的正常大脑蛋白质的过度积累引起的。无论tau蛋白聚集在哪里,附近的脑组织就会开始退化和死亡。
现在,圣路易斯华盛顿大学医学院的研究人员在老鼠身上发现,大脑中类似阿尔茨海默病的tau沉积会导致一种被称为胆固醇酯的胆固醇的积累,而降低胆固醇酯的水平有助于防止脑损伤和行为改变。
“这具有重要的治疗意义,”资深作者David M. Holtzman医学博士说,他是Barbara Burton和Reuben M. morris III神经病学杰出教授。“我们在这项研究中使用的化合物有副作用,不适合用于人类。但如果你能开发出一种降低脑细胞内胆固醇酯的疗法,而不会产生不可接受的副作用,那么它将是一种很有希望用于神经退行性疾病测试的候选者。”
研究结果发表在11月22日的《神经元》杂志上。

图1 LXR激动剂改善Tau和ApoE4相关的胶质细胞脂质积聚和神经退行性变
胆固醇和痴呆之间的联系并不像看起来那么牵强。阿尔茨海默氏症最大的遗传风险因素是APOE,一种参与激活大脑免疫细胞的基因。当这些细胞以错误的方式或在错误的时间被激活时,它们会损害脑组织。但APOE在体内还有另一个重要的作用:它在血液中携带胆固醇和其他脂质。在这种情况下,它在动脉粥样硬化中起作用。
为了研究APOE,脂质和脑损伤之间的联系,Holtzman和第一作者,博士后研究员Alexandra Litvinchuk博士,研究了具有高风险tau基因的小鼠,这种基因使它们易于在大脑中积累tau。这些老鼠大约在6个月大的时候开始出现神经退化的迹象。到9个半月时,它们的大脑严重受损,它们不再能够完成老鼠生活中的普通任务,比如正确地筑巢。这些小鼠还携带了第二种基因修饰:它们自己的APOE基因被移除,要么被人类APOE基因的一种变体——APOE3取代,APOE3会导致患阿尔茨海默氏症的平均风险;或者APOE4,它会使患阿尔茨海默氏症的风险增加一倍或两倍——或者根本不被替换。
研究表明,APOE4与大脑中扭曲的脂质代谢有关。在9个半月大的携带APOE4的tau小鼠中,萎缩和受损的大脑区域也以一种奇怪的模式积聚了多余的脂质。180多种脂质的水平发生了变化。最显著的差异之一是,这些区域被称为小胶质细胞的免疫细胞充满了胆固醇酯。APOE3没有同样的效果。脑脂质的测量是与Gilbert Di Paolo博士领导的Denali Therapeutics公司的科学家合作完成的。
“充满脂质的小胶质细胞变得过度炎症,并开始分泌对大脑不利的东西,”Holtzman说。
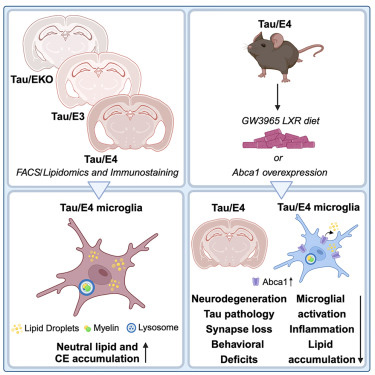
图2 载脂蛋白E(APOE)是晚发性阿尔茨海默病的一个强的遗传风险因素
因此,清除脂质可能会减少脑部炎症和神经退化,他说。为了找到答案,Litvinchuk和Holtzman使用了一种LXR激动剂,这是一种降低细胞脂质水平的实验性药物。研究人员从6个月大的时候开始给携带APOE4的tau小鼠喂食这种名为GW3965的药物。这些老鼠在9个半月大的时候接受了评估,此时它们的大脑通常已经遭受了相当大的损伤。服用这种药物的老鼠比服用安慰剂的老鼠保留了更多的脑容量。他们的tau蛋白水平更低,炎症细胞和炎症更少,大脑中突触的损失更少,而且更擅长筑巢。
进一步的研究表明,LXR激动剂通过上调一种名为Abca1的基因起作用,该基因有助于将胆固醇和其他脂质移出细胞。使用遗传方法增加Abca1水平具有与药物治疗相同的效果:减少脂质积累,降低tau水平,减少炎症和减少神经变性。
“令人兴奋的是,我们在动物模型中看到了所有这些影响,这些影响与人类神经退行性疾病有很多共同的特征,”Holtzman说。“这表明,这种方法可能有很大的前景。”
Holtzman补充说,将这种方法应用于人类的一个主要障碍是。LXR激动剂也会影响肝脏的脂质代谢,因此它们容易引起脂肪肝疾病。化学家们正在努力设计没有这种副作用的LXR激动剂。如果他们成功了,所产生的药物可能对心脏病和脑部疾病都有好处。
“在阿尔茨海默病中,驱动免疫细胞损伤大脑的机制与驱动同种免疫细胞导致动脉粥样硬化中血管损伤的机制有很多相似之处,在这两种情况下,脂质都在免疫细胞中积聚,导致它们过度炎症,损害附近的组织。摆脱这种脂质积累可能对人体健康有双重好处。”
参考资料
[1] Amelioration of Tau and ApoE4-linked glial lipid accumulation and neurodegeneration with an LXR agonist
摘要:圣路易斯华盛顿大学医学院的研究人员发现,一种被称为胆固醇酯的胆固醇在患有类似阿尔茨海默病的老鼠的大脑中积累,清除胆固醇酯有助于防止脑损伤和行为改变。
在阿尔茨海默病和相关的痴呆症中,认知能力下降是由一种被称为tau的正常大脑蛋白质的过度积累引起的。无论tau蛋白聚集在哪里,附近的脑组织就会开始退化和死亡。
现在,圣路易斯华盛顿大学医学院的研究人员在老鼠身上发现,大脑中类似阿尔茨海默病的tau沉积会导致一种被称为胆固醇酯的胆固醇的积累,而降低胆固醇酯的水平有助于防止脑损伤和行为改变。
“这具有重要的治疗意义,”资深作者David M. Holtzman医学博士说,他是Barbara Burton和Reuben M. morris III神经病学杰出教授。“我们在这项研究中使用的化合物有副作用,不适合用于人类。但如果你能开发出一种降低脑细胞内胆固醇酯的疗法,而不会产生不可接受的副作用,那么它将是一种很有希望用于神经退行性疾病测试的候选者。”
研究结果发表在11月22日的《神经元》杂志上。

图1 LXR激动剂改善Tau和ApoE4相关的胶质细胞脂质积聚和神经退行性变
胆固醇和痴呆之间的联系并不像看起来那么牵强。阿尔茨海默氏症最大的遗传风险因素是APOE,一种参与激活大脑免疫细胞的基因。当这些细胞以错误的方式或在错误的时间被激活时,它们会损害脑组织。但APOE在体内还有另一个重要的作用:它在血液中携带胆固醇和其他脂质。在这种情况下,它在动脉粥样硬化中起作用。
为了研究APOE,脂质和脑损伤之间的联系,Holtzman和第一作者,博士后研究员Alexandra Litvinchuk博士,研究了具有高风险tau基因的小鼠,这种基因使它们易于在大脑中积累tau。这些老鼠大约在6个月大的时候开始出现神经退化的迹象。到9个半月时,它们的大脑严重受损,它们不再能够完成老鼠生活中的普通任务,比如正确地筑巢。这些小鼠还携带了第二种基因修饰:它们自己的APOE基因被移除,要么被人类APOE基因的一种变体——APOE3取代,APOE3会导致患阿尔茨海默氏症的平均风险;或者APOE4,它会使患阿尔茨海默氏症的风险增加一倍或两倍——或者根本不被替换。
研究表明,APOE4与大脑中扭曲的脂质代谢有关。在9个半月大的携带APOE4的tau小鼠中,萎缩和受损的大脑区域也以一种奇怪的模式积聚了多余的脂质。180多种脂质的水平发生了变化。最显著的差异之一是,这些区域被称为小胶质细胞的免疫细胞充满了胆固醇酯。APOE3没有同样的效果。脑脂质的测量是与Gilbert Di Paolo博士领导的Denali Therapeutics公司的科学家合作完成的。
“充满脂质的小胶质细胞变得过度炎症,并开始分泌对大脑不利的东西,”Holtzman说。

图2 载脂蛋白E(APOE)是晚发性阿尔茨海默病的一个强的遗传风险因素
因此,清除脂质可能会减少脑部炎症和神经退化,他说。为了找到答案,Litvinchuk和Holtzman使用了一种LXR激动剂,这是一种降低细胞脂质水平的实验性药物。研究人员从6个月大的时候开始给携带APOE4的tau小鼠喂食这种名为GW3965的药物。这些老鼠在9个半月大的时候接受了评估,此时它们的大脑通常已经遭受了相当大的损伤。服用这种药物的老鼠比服用安慰剂的老鼠保留了更多的脑容量。他们的tau蛋白水平更低,炎症细胞和炎症更少,大脑中突触的损失更少,而且更擅长筑巢。
进一步的研究表明,LXR激动剂通过上调一种名为Abca1的基因起作用,该基因有助于将胆固醇和其他脂质移出细胞。使用遗传方法增加Abca1水平具有与药物治疗相同的效果:减少脂质积累,降低tau水平,减少炎症和减少神经变性。
“令人兴奋的是,我们在动物模型中看到了所有这些影响,这些影响与人类神经退行性疾病有很多共同的特征,”Holtzman说。“这表明,这种方法可能有很大的前景。”
Holtzman补充说,将这种方法应用于人类的一个主要障碍是。LXR激动剂也会影响肝脏的脂质代谢,因此它们容易引起脂肪肝疾病。化学家们正在努力设计没有这种副作用的LXR激动剂。如果他们成功了,所产生的药物可能对心脏病和脑部疾病都有好处。
“在阿尔茨海默病中,驱动免疫细胞损伤大脑的机制与驱动同种免疫细胞导致动脉粥样硬化中血管损伤的机制有很多相似之处,在这两种情况下,脂质都在免疫细胞中积聚,导致它们过度炎症,损害附近的组织。摆脱这种脂质积累可能对人体健康有双重好处。”
参考资料
[1] Amelioration of Tau and ApoE4-linked glial lipid accumulation and neurodegeneration with an LXR agonist



