摘要:病毒和非病毒CRISPR-Cas9传递载体的一个大问题是它们不能准确地靶向特定的组织或细胞。
浙江大学的科学家们已经开发出一种新的CRISPR-Cas9递送载体,在治疗肺癌方面比脂质纳米颗粒(LNPs)更有效。快速液氮治疗可以将肿瘤细胞转化为体内靶向癌症的基因编辑工具的载体。低温休克在保留肿瘤细胞结构和表面受体功能的同时,消除了肿瘤细胞的致病性。
在非小细胞肺癌(NSCLC)小鼠模型中,这种装载CRISPR-Cas9的递送系统有效地靶向肺部,消融肿瘤并延长生存时间。由于这种液氮冷冻灭活技术,从手术切除、穿刺活检或其他遗留下来的肿瘤中收集的细胞可以被冷冻,并再次用作基因编辑工具,以对抗癌症。
这篇题为《Cryo-shocked tumor cells deliver CRISPR-Cas9 for lung cancer regression by synthetic lethality》的研究论文发表在《Science Advances》杂志上。本研究提出了一种利用冷冻休克的肺肿瘤细胞作为CRISPR-Cas9递送系统,针对KRAS突变的非小细胞肺癌(NSCLC)进行周期素依赖性激酶4(CDK4)基因编辑的策略。通过快速液氮休克处理,有效地消除了肿瘤细胞的致病性,同时保留了它们的结构和表面受体活性。这种递送系统使得加载的CRISPR-Cas9能够有效地靶向肺部,通过在肺毛细血管中的捕获以及与内皮细胞的相互作用。在携带NSCLC的小鼠模型中,与CRISPR-Cas9脂质体纳米颗粒给药相比,药物在肺部的积累增加了近四倍,并且肿瘤内CDK4表达显著下调。此外,CRISPR-Cas9编辑介导的CDK4消融触发了KRAS突变NSCLC的合成致死效应,并延长了小鼠的生存时间。

图1 冷冻休克肿瘤细胞通过合成致死性递送CRISPR-Cas9用于癌症消退
基于细胞的基因编辑运载工具
CRISPR-Cas9基因组编辑系统作为检测和治疗癌症、病毒感染和遗传性疾病的工具显示出巨大的前景。CRISPR-Cas9在血液中的降解或变性问题以及低效的递送是其更广泛临床应用的两个障碍。
目前的病毒和非病毒CRISPR-Cas9传递载体的一个大问题是它们不能准确地靶向特定的组织或细胞。此外,免疫原性、脱靶基因效应和剂量限制性毒性等问题阻碍了病毒和LNPs等基因传递载体在体内的进一步使用,尽管它们的基因编辑效率很高。
由于其同源蛋白成分,与这些合成和外源基因载体相比,基于细胞的载体表现出优越的靶向能力。不幸的是,由于某些类型的活细胞可能具有生理毒性或致病性,因此其临床应用受到限制。
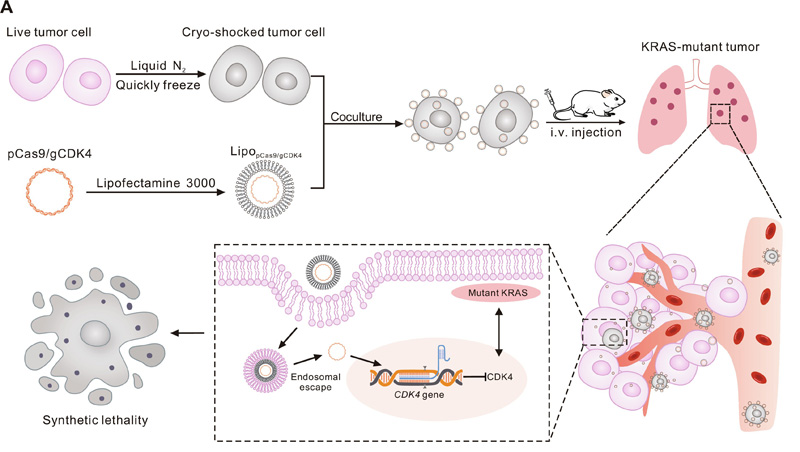
图2 LNT细胞的特性
利用低温休克细胞作为靶基因载体
Feng Liu和Minhang Xin的合作研究表明,将肿瘤细胞快速浸泡在液氮中,可以在保持其结构完整性的同时使其失活并变得无害。维持液氮处理细胞的功能蛋白池,通过与内皮细胞的相互作用增强其主动靶向肺部的能力。此外,用具有同源受体的液氮处理的细胞可以通过增加与肿瘤细胞相互作用的可能性来提高药物递送效率和同源靶向。由于液氮处理细胞比剥夺细胞的囊泡更大,具有更高的电位,因此这种CRISPR-Cas9递送系统更有可能被肺毛细血管捕获,从而改善肺潴留。
Liu, Xin和同事使用肺靶向CRISPR-Cas9药物递送策略敲低肿瘤中的细胞周期蛋白依赖性激酶4 (CDK4),导致KRAS突变的非小细胞肺癌小鼠模型的合成致死。为了在体内传递CRISPR-Cas9,使用冷冻灭活的非致病性KRAS突变的NSCLC细胞作为载体。由于完整的细胞结构和保存的细胞表面糖蛋白CD44,这种细胞载体可以通过肺毛细血管的被动捕获和CD44介导的细胞相互作用和粘附,实现高度靶向的肺递送。虽然这种低温灭活细胞递送系统可能导致CDK4消融和KRAS突变的NSCLC细胞死亡,但它不会影响正常细胞。
用液氮处理的细胞保留了肿瘤抗原,表明它们可能在肿瘤免疫治疗中作为疫苗有用。因此,用液氮处理的细胞可以作为分配免疫调节药物的载体。液氮治疗的另一个优点是它允许重新使用从废弃肿瘤中获得的细胞,术后切除或穿刺活检。
参考资料
[1] Crimean–Congo haemorrhagic fever virus uses LDLR to bind and enter host cells
摘要:病毒和非病毒CRISPR-Cas9传递载体的一个大问题是它们不能准确地靶向特定的组织或细胞。
浙江大学的科学家们已经开发出一种新的CRISPR-Cas9递送载体,在治疗肺癌方面比脂质纳米颗粒(LNPs)更有效。快速液氮治疗可以将肿瘤细胞转化为体内靶向癌症的基因编辑工具的载体。低温休克在保留肿瘤细胞结构和表面受体功能的同时,消除了肿瘤细胞的致病性。
在非小细胞肺癌(NSCLC)小鼠模型中,这种装载CRISPR-Cas9的递送系统有效地靶向肺部,消融肿瘤并延长生存时间。由于这种液氮冷冻灭活技术,从手术切除、穿刺活检或其他遗留下来的肿瘤中收集的细胞可以被冷冻,并再次用作基因编辑工具,以对抗癌症。
这篇题为《Cryo-shocked tumor cells deliver CRISPR-Cas9 for lung cancer regression by synthetic lethality》的研究论文发表在《Science Advances》杂志上。本研究提出了一种利用冷冻休克的肺肿瘤细胞作为CRISPR-Cas9递送系统,针对KRAS突变的非小细胞肺癌(NSCLC)进行周期素依赖性激酶4(CDK4)基因编辑的策略。通过快速液氮休克处理,有效地消除了肿瘤细胞的致病性,同时保留了它们的结构和表面受体活性。这种递送系统使得加载的CRISPR-Cas9能够有效地靶向肺部,通过在肺毛细血管中的捕获以及与内皮细胞的相互作用。在携带NSCLC的小鼠模型中,与CRISPR-Cas9脂质体纳米颗粒给药相比,药物在肺部的积累增加了近四倍,并且肿瘤内CDK4表达显著下调。此外,CRISPR-Cas9编辑介导的CDK4消融触发了KRAS突变NSCLC的合成致死效应,并延长了小鼠的生存时间。

图1 冷冻休克肿瘤细胞通过合成致死性递送CRISPR-Cas9用于癌症消退
基于细胞的基因编辑运载工具
CRISPR-Cas9基因组编辑系统作为检测和治疗癌症、病毒感染和遗传性疾病的工具显示出巨大的前景。CRISPR-Cas9在血液中的降解或变性问题以及低效的递送是其更广泛临床应用的两个障碍。
目前的病毒和非病毒CRISPR-Cas9传递载体的一个大问题是它们不能准确地靶向特定的组织或细胞。此外,免疫原性、脱靶基因效应和剂量限制性毒性等问题阻碍了病毒和LNPs等基因传递载体在体内的进一步使用,尽管它们的基因编辑效率很高。
由于其同源蛋白成分,与这些合成和外源基因载体相比,基于细胞的载体表现出优越的靶向能力。不幸的是,由于某些类型的活细胞可能具有生理毒性或致病性,因此其临床应用受到限制。

图2 LNT细胞的特性
利用低温休克细胞作为靶基因载体
Feng Liu和Minhang Xin的合作研究表明,将肿瘤细胞快速浸泡在液氮中,可以在保持其结构完整性的同时使其失活并变得无害。维持液氮处理细胞的功能蛋白池,通过与内皮细胞的相互作用增强其主动靶向肺部的能力。此外,用具有同源受体的液氮处理的细胞可以通过增加与肿瘤细胞相互作用的可能性来提高药物递送效率和同源靶向。由于液氮处理细胞比剥夺细胞的囊泡更大,具有更高的电位,因此这种CRISPR-Cas9递送系统更有可能被肺毛细血管捕获,从而改善肺潴留。
Liu, Xin和同事使用肺靶向CRISPR-Cas9药物递送策略敲低肿瘤中的细胞周期蛋白依赖性激酶4 (CDK4),导致KRAS突变的非小细胞肺癌小鼠模型的合成致死。为了在体内传递CRISPR-Cas9,使用冷冻灭活的非致病性KRAS突变的NSCLC细胞作为载体。由于完整的细胞结构和保存的细胞表面糖蛋白CD44,这种细胞载体可以通过肺毛细血管的被动捕获和CD44介导的细胞相互作用和粘附,实现高度靶向的肺递送。虽然这种低温灭活细胞递送系统可能导致CDK4消融和KRAS突变的NSCLC细胞死亡,但它不会影响正常细胞。
用液氮处理的细胞保留了肿瘤抗原,表明它们可能在肿瘤免疫治疗中作为疫苗有用。因此,用液氮处理的细胞可以作为分配免疫调节药物的载体。液氮治疗的另一个优点是它允许重新使用从废弃肿瘤中获得的细胞,术后切除或穿刺活检。
参考资料
[1] Crimean–Congo haemorrhagic fever virus uses LDLR to bind and enter host cells



