本文聚焦于人类肠道微生物群中适应性等位基因的传播机制,提出并验证了新型统计方法iLDS(integrated linkage disequilibrium score),揭示了肠道菌群通过水平基因转移(HGT)实现快速适应性演化的普遍规律,并首次量化了工业化和非工业化饮食对菌群选择压力的差异化影响
Science:首次从分子层面上解释染色体碎裂是如何发生的
加州大学圣地亚哥分校的科学家们近日发现,一种名为N4BP2的胞质核酸酶驱动了染色体碎裂。这种酶可侵入破裂的微核并引发DNA损伤,最终导致染色体片段化。
普通药物可能会影响CRISPR治疗结果和精确的癌症治疗
在一项新的研究中,莱比锡马克斯普朗克进化人类学研究所的科学家分析了2000多种临床批准的药物对DNA修复和CRISPR基因组编辑结果的影响。他们发现了可用于改善基因组编辑的化合物,选择性杀死培养癌细胞的分子,并进一步确定了两种蛋白质在DNA修复中的新作用。

《自然-衰老》:CAR-T疗法助力肠道健康
冷泉港实验室(CSHL)的生物学家们研发出一种刺激肠道细胞生长和修复的新方法。他们成功的关键在于CAR-T细胞疗法,一种新型免疫疗法。他们的研究成果有望为旨在改善某些老年相关疾病患者肠道健康的临床试验奠定基础。衰老细胞与一系列年龄相关疾病有关,包括糖尿病和痴呆症。阿莫尔·维加斯的实验室此前曾构建了一种名为 抗uPAR CAR T细胞的特殊免疫细胞 ,用于清除小鼠体内的衰老细胞,从而显著改善小鼠的新陈代谢。
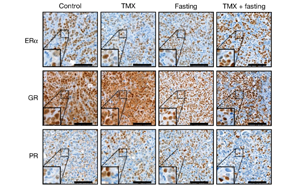
禁食通过激活糖皮质激素来提高乳腺癌治疗的疗效
意大利都灵理工大学和米兰理工大学的研究团队通过整合表观基因组学、转录组学及临床前模型,揭示了间歇性禁食(IF)通过激活糖皮质激素受体(GR)和孕激素受体(PR)增强内分泌治疗疗效的分子机制,并首次提出外源性GR激动剂可能替代传统饮食干预。

NEDD4L通过泛素化Gasdermin D/E抑制细胞焦亡:炎症调控的新机制
研究人员在《Cell Death and Differentiation》上发表了最新研究成果。他们采用基因敲除小鼠模型,结合细胞生物学和生物化学技术,系统阐明了NEDD4L对GSDMD和GSDME的泛素化调控机制。

《Nature Metabolism》一种意想不到的天然肠道分子具有显著的抗糖尿病作用
研究人员已经发现了一种意想不到的天然化合物,有助于对抗胰岛素抵抗和2型糖尿病。这种化合物,三甲胺(TMA),是肠道微生物从饮食胆碱中产生的代谢物。根据《Nature Metabolism》杂志的一项研究,TMA可以中断一个关键的免疫途径,有助于健康的血糖水平。
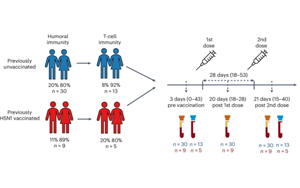
《自然微生物学》:H5N8禽流感疫苗可产生强烈的免疫反应
发表在《自然微生物学》上的一项新研究表明,MF59佐剂A(H5N8)疫苗能够诱导强烈的免疫反应,包括针对疫苗病毒的功能性抗体和记忆性T细胞反应,以及针对近期在欧洲和美国爆发的H5病毒的免疫反应。
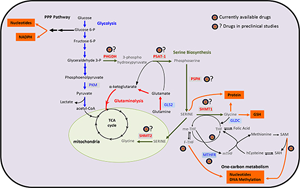
糖酵解来源的丝氨酸代谢受损是衰老相关足细胞损伤的关键驱动因素
研究聚焦慢性肾脏病(CKD)中足细胞衰老的关键难题,揭示了血管紧张素II(Ang II)通过转录因子FOXA1下调磷酸甘油酸激酶1(PGK1),导致L-丝氨酸合成减少、线粒体功能障碍和细胞衰老的新机制。研究发现补充L-丝氨酸或增强PGK1表达可激活PI3K/AKT通路,减少脱氧鞘脂积累,显著改善足细胞损伤。